

分析 (1)CO2物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,NaOH物质的量为0.1L×3mol/L=0.3mol,由于1<n(NaOH):n(CO2)=3:2<2,发生反应:2CO2+3NaOH=Na2CO3+NaHCO3+H2O,Na2CO3、NaHCO3的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,碳酸根离子的水解能力大于碳酸氢根离子;
(2)反应①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反应②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根据盖斯定律,①+②可得CO2(g)+3H2(g)?CH3OH(g)+H2O(l),反应热也进行相应计算;
该反应的化学平衡常数K=$\frac{c({CH}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$×$\frac{c({H}_{2}O)×c(CO)}{c({H}_{2})×c(C{O}_{2})}$;
(3)相同时间内,CH4产量越高,反应催化效果越好;
(4)在t1时刻改变一个条件,曲线a变为b,缩短到达平衡的时间,反应速率加快,平衡时CO的浓度不变,改变不影响平衡移动,不可能是升高温度,反应②是反应前后气体的物质的量不变的反应,增大压强平衡不移动,但CO的浓度会增大,可能改变的条件是加入催化剂;
若在t1时刻,将容器体积3L快速压缩至2L,压强增大,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时CO的浓度变为$\frac{0.3mol/L×3L}{2L}$=0.45mol/L,在t1时刻瞬间CO的浓度为0.3mol/L;
(5)将BaSO4转化成BaCO3的离子方程式:BaSO4(s)+CO32-(aq)=BaCO3 (s)+SO42-(aq),该反应的平衡常数K=$\frac{\frac{Ksp(BaS{O}_{4})}{c(B{a}^{2+})}}{\frac{Ksp(BaC{O}_{3})}{c(B{a}^{2+})}}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$.
解答 解:(1)CO2物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,NaOH物质的量为0.1L×3mol/L=0.3mol,由于1<n(NaOH):n(CO2)=3:2<2,发生反应:2CO2+3NaOH=Na2CO3+NaHCO3+H2O,Na2CO3、NaHCO3的物质的量相等,碳酸根离子和碳酸氢根离子水解而使溶液呈碱性,即c(OH-)>c(H+),碳酸根离子水解生成碳酸氢根离子,所以c(HCO3-)>c(CO32-),由于水解程度较小,所以c(CO32-)>c(OH-),故溶液中各离子浓度大小顺序是c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(2)反应①:2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ•mol-1
反应②:H2(g)+CO2(g)?H2O(g)+CO(g)△H=+41.2kJ•mol-1
根据盖斯定律,①+②可得:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-49.6kJ/mol,
该反应的化学平衡常数K=$\frac{c({CH}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{c(C{H}_{3}OH)}{{c}^{2}({H}_{2})×c(CO)}$×$\frac{c({H}_{2}O)×c(CO)}{c({H}_{2})×c(C{O}_{2})}$=2.5×1=2.5,
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H=-49.6kJ/mol;2.5;
(3)由图可知,在0-15h内,催化剂Ⅱ在相同时间内CH4产量高,对反应催化效果最好的催化剂是Ⅱ,
故答案为:Ⅱ;
(4)在t1时刻改变一个条件,曲线a变为b,缩短到达平衡的时间,反应速率加快,平衡时CO的浓度不变,改变不影响平衡移动,不可能是升高温度,反应②是反应前后气体的物质的量不变的反应,增大压强平衡不移动,但CO的浓度会增大,可能改变的条件是加入催化剂;
若在t1时刻,将容器体积3L快速压缩至2L,压强增大,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时CO的浓度变为$\frac{0.3mol/L×3L}{2L}$=0.45mol/L,在t1时刻瞬间CO的浓度为0.3mol/L,画出变化曲线为: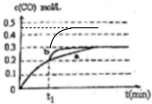 ,
,
故答案为:加入催化剂; ;
;
(5)将BaSO4转化成BaCO3的离子方程式:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq),该反应的平衡常数K=$\frac{\frac{Ksp(BaS{O}_{4})}{c(B{a}^{2+})}}{\frac{Ksp(BaC{O}_{3})}{c(B{a}^{2+})}}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{2.5×1{0}^{-9}}$=0.044,
故答案为:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq);0.044.
点评 本题考查平衡常数有关计算、化学平衡计算及影响因素、离子浓度大小比较、热化学方程式书写等,题目涉及内容较多,基本属于拼合型题目,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若不改变其它条件而换用一种更高效的催化剂,则反应达限度的时间会增长 | |
| B. | 达平衡后向容器中只充入O2不能提高反应速率 | |
| C. | 达到平衡时,SO2的转化率是80% | |
| D. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为114.90g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:
)是一种食用香料,主要用于配制具有醋栗、桃、草莓、樱桃、可可、巧克力等各种香气浓厚的香精.其中一种合成路线如下:

 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. +(CH3)2CHCH2OH$→_{△}^{浓硫酸}$
+(CH3)2CHCH2OH$→_{△}^{浓硫酸}$ +H2O,反应类型为酯化反应或取代反应.
+H2O,反应类型为酯化反应或取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com