
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响,能表明同一规律的实验还有 (填实验序号);
(2)本实验中影响反应速率的除了浓度还有 ,仅表明该因素对反应速率产生影响的实验有 (填实验序号)。
(3)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
。
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是
A.HClO的结构式:H—Cl—O B.氨气分子的比例模型
C.原子核内有10个中子的氧原子: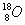 D.H2与H+互为同位素
D.H2与H+互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )。
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=1×10-14
B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液
C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列性质的递变中,正确的是( )
A.O、Na、S的原子半径依次增大 B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强 D.HCl、HBr、HI的还原性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是一种既高效又清洁的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
①原料来源广;②易燃烧、热值高;③储存方便;④制备工艺廉价易行
A.③④ B.①② C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.需要持续加热才能维持的化学反应一定是吸热反应
B.中和反应放热说明水和盐的总能量高于酸和碱的总能量
C.C(s) + 1/2O2(g) = CO(g) △H =-110.5 kJ/mol,则石墨的燃烧热为
110.5 kJ/mol
D.1 mol/L醋酸和1 mol/L NaOH溶液中和所放出的热量小于1 mol/L盐酸和1 mol/L NaOH溶液中和所放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:重铬酸根离子(Cr2O72—)是橙红色的,铬酸根离子(CrO42-)是黄色的,重铬酸钾溶于水发生反应:Cr2O72-+H2O 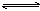 2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量6mol/L的硫酸,溶液呈________色,原因是
2CrO42-+2H+,溶液为橙黄色,向溶液中滴加少量6mol/L的硫酸,溶液呈________色,原因是
。
 (2)已知:2NO2 N2O4 ΔH= -56.9kJ/mol。一定条件下,将该混合体系置于一个带活塞的体积可变的密闭容器中,推动活塞以减小容器的体积,此时的现象是________________________________,原因是_________________________。
(2)已知:2NO2 N2O4 ΔH= -56.9kJ/mol。一定条件下,将该混合体系置于一个带活塞的体积可变的密闭容器中,推动活塞以减小容器的体积,此时的现象是________________________________,原因是_________________________。
(3)将NO2和N2O4混合气体置于恒容密闭容器中,将该体系升温至100oC,此时的现象是_________________________,原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);ΔH = + Q kJ/mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com