
(16分)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
(1)已知:①2CO(g)+O2(g)=2CO2(g) H1=a kJmol-1
②2NO(g)+2CO(g) N2(g)+ 2CO2(g) H2=b kJmol-1
则反应N2(g)+ O2(g)= 2NO(g)的H= kJmol-1(用a、b表示)。
(2)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,20S反应达平衡,此时CO的物质的量为1.6 mol。请回答下列问题:
①前20S内平均反应速率v(NO)为 。
②在该温度下反应的平衡常数K= 。
③关于上述反应,下列叙述不正确的是 (填编号)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ。若其它条件不变,将0.5 mol NO、2 mol CO投入2 L容器进行反应,请在答题卡图中绘出c(CO)与反应时间t1变化曲线Ⅱ。

(3)测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如下图

请回答:前0—10 s 阶段,CO、NO百分含量没明显变化的原因是 。
(16分)
(1)a-b (2分)
(2)①0.02mol·L-1·S-1 ②1.25 ③AD(各3分,共9分)
④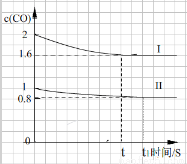
(起点,1分;终点的时间比t长,1分;c(CO) 比0.8略高些,1分,共3分)
(3)尚未达到催化剂工作温度(或尚未达到反应的温度) (2分)
【解析】
试题分析:(1)根据盖斯定律,反应N2(g)+ O2(g)= 2NO(g)的H=H1—H2=(a-b)kJmol-1。
(2)①根据三段式进行计算,2NO(g)+2CO(g) N2(g)+ 2CO2(g)
初始浓度(molL1) 0.5 2 0 0
转化浓度(molL1) 0.4 0.4 0.2 0.4
平衡浓度(molL1) 0.1 1.6 0.2 0.4
则前20S内平均反应速率v(NO)=0.4mol/L÷20S=0.02mol·L-1·S-1。
②该温度下反应的平衡常数K=0.2×0.42÷(0.12×1.62)=1.25。
③A、达到平衡时,移走部分CO2,生成物浓度减小,平衡将向右移动,反应物浓度逐渐减小,正反应速率减小,故A错误;B、缩小容器的体积,气体的压强增大,平衡将向右移动,故B正确;C、因为催化剂能同等倍数的增大正反应速率和逆反应速率,所以应选用乙催化剂,故C正确;D、若保持平衡时的温度和压强不变,再向容器中充入0.4molCO和0.8mol N2,则浓度商Q=1×0.42÷(0.12×1.62)=4 >K,所以反应向左进行,即v正 < v逆,故D错误。
④将0.5 mol NO、2 mol CO投入2 L容器进行反应,则起始时CO的浓度为1molL1,因为起始浓度变为原反应的1/2,所以反应速率减小,则达到化学平衡的时间变长,因为容积为2L,为原反应的2倍,所以压强减小,平衡向左移动,则c(CO) > 0.8,可画出图像。
(3)催化剂的催化作用需要在一定温度下才能充分体现出来,所以前0—10 s 阶段,CO、NO百分含量没明显变化的原因是:尚未达到催化剂工作温度(或尚未达到反应的温度)。
考点:本题考查盖斯定律的应用、化学反应速率、化学平衡移动及计算、图像的分析及绘制。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:2014-2015湖南省娄底市高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
下列物质中,含有共价键的化合物是
A.H2 B.Al C.KI D.CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省娄底市高二上学期期末考试化学(理)试卷(解析版) 题型:选择题
下列反应属于加成反应的是
A.甲烷与氯气的混合气体在光照条件下的反应
B.丙烯和氯气在一定条件下生成ClCH2CH=CH2的反应
C.乙烯使酸性高锰酸钾溶液褪色的反应
D.乙烯与溴水的反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省清远市高三上学期期末理综化学试卷(解析版) 题型:填空题
(16分)随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,CO2的排放量也要大幅减少。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H1=-574kJ·mol-1
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H2
③CH4(g) + 2NO2 (g) = N2(g) + CO2(g) + 2H2O(g) △H3=-867kJ·mol-1
则△H2 = 。
Ⅱ.化石燃料的燃烧、含硫金属矿石的冶炼和硫酸的生产过程中产生的SO2是大气中SO2的主要来源。
(1)将煤转化为水煤气是将煤转化为洁净燃料的方法之一,反应为C(s) + H2O(g)  CO(g) + H2(g)
CO(g) + H2(g)
①该反应的化学平衡常数表达式为:K= 。
②800℃时,将1molCO、3mol H2O、1mol H2充入容积为1L的容器中,发生反应: CO(g) + H2O(g)  CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为_________,800℃时该反应的平衡常数为_________。
CO2(g) + H2(g),一定时间后达到平衡时,测得容器中CO2浓度为0.5mol·L-1,则CO的转化率为_________,800℃时该反应的平衡常数为_________。
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应_______________________________________。
②用化学平衡移动的原理分析,在 HI分解反应中使用膜反应器分离出H2的目的是: ___________。
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g) CH3COOH(g)直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率
CH3COOH(g)直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率
如图所示。由下图可以得出的结论是(写两条):_____________________、___________________。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省清远市高三上学期期末理综化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数,下列说法正确的是
A.同温同压同体积的CO2和SO2所含氧原子数均为2NA
B.32gCu与S完全反应转移的电子数为NA(相对原子质量 Cu:64)
C.1L 1.0mol·L—1 NH4Cl与2L 0.5mol·L—1 NH4Cl溶液含NH4+数目相同
D.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH— 数目为0.1NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省茂名市高三一模考试理综化学试卷(解析版) 题型:选择题
某小组进行电化学研究,甲同学设计如下图的装置图,乙同学利用甲的装置和桌面其他的药品与材料,不能完成的实验是
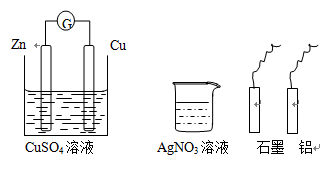
A.使甲同学的正极变为负极
B.设计一个新的原电池
C.在碳电极上镀锌
D.使锌电极受到保护
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:填空题
【选修2—化学与技术】(14分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:

(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。(1分)
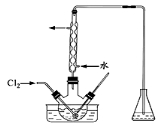
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
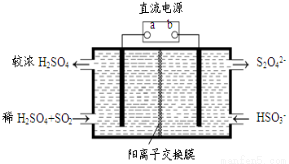
①阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是:
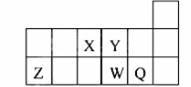
A.元素Y与元素Z的最高正化合价之和的数值等于9
B.原子半径的大小顺序为:W>Z>Y
C.离子半径的大小顺序为:W2->Y2->Z3+
D.W的气态氢化物的热稳定性和还原性均比Q强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是
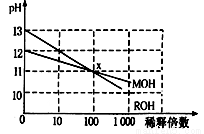
A.ROH是一种强碱
B.在x点,MOH未完全电离
C.在x点,c(M+)=c(R+)
D.稀释前,c(ROH)=10c(MOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com