
| t/min | 平衡时的热量变化 | |||||||
| 0 | 20 | 40 | 60 | 80 | 120 | |||
| 第一组 | X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 | 放出Q1kJ |
| 第二组 | X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 | 吸收Q2kJ |
| A. | Q1+Q2=11a(a>0) | |
| B. | k正=K•k逆(K为已知反应的平衡常数,下同) | |
| C. | K=$\frac{0.21{6}^{2}}{0.10{8}^{2}}$ | |
| D. | 相同温度下,在第二组平衡后的混合气体中再加入2molHI,重新达到平衡后,HI的转化率为21.6% |
分析 A.第一组假设开始时加入amol氢气、amol碘,反应达到平衡时HI的物质的量分数为0.784,反应前后气体总物质的量不变,所以反应达到平衡状态时n(HI)=0.784amol×2=1.568amol,生成2molHI放出11kJ热量,则生成1.568amol放出热量Q1=$\frac{1.586amol}{2mol}×11kJ$=(0.784a×11)kJ;
第二组假设开始时加入2amolHI,达到平衡状态时n(HI)=0.784×2amol=1.568amol,则参加反应的n(HI)=2amol(1-0.784)=2amol×0.216,放出的热量Q2=$\frac{0.216×2amol}{2mol}×11kJ/mol$=(0.216a×11)kJ;
B.反应达到平衡状态时正逆反应速率相等,k正•x(H2)•x(I2)=v正=v逆=k逆•x2(HI),
则k正=k逆$\frac{{x}^{2}(HI)}{x({H}_{2}).x({I}_{2})}$;
C.根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,其化学平衡常数K=$\frac{x({H}_{2}).x({I}_{2})}{{x}^{2}(HI)}$;
D.相同温度下,在第二组平衡后的混合气体中再加入2molHI,相当于增大压强,平衡不移动,HI转化率不变.
解答 解:A.第一组假设开始时加入amol氢气、amol碘,反应达到平衡时HI的物质的量分数为0.784,反应前后气体总物质的量不变,所以反应达到平衡状态时n(HI)=0.784amol×2=1.568amol,生成2molHI放出11kJ热量,则生成1.568amol放出热量Q1=$\frac{1.586amol}{2mol}×11kJ$=(0.784a×11)kJ;
第二组假设开始时加入2amolHI,达到平衡状态时n(HI)=0.784×2amol=1.568amol,则参加反应的n(HI)=2amol(1-0.784)=2amol×0.216,放出的热量Q2=$\frac{0.216×2amol}{2mol}×11kJ/mol$=(0.216a×11)kJ,Q1+Q2=(0.784a×11)kJ+(0.216a×11)kJ=11akJ,故A正确;
B.反应达到平衡状态时正逆反应速率相等,k正•x(H2)•x(I2)=v正=v逆=k逆•x2(HI),
则k正=k逆$\frac{{x}^{2}(HI)}{x({H}_{2}).x({I}_{2})}$=K•k逆(K为已知反应的平衡常数,下同),故B正确;
C.根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,其化学平衡常数K=$\frac{x({H}_{2}).x({I}_{2})}{{x}^{2}(HI)}$=$\frac{0.10{8}^{2}}{0.78{4}^{2}}$,故C错误;
D.相同温度下,在第二组平衡后的混合气体中再加入2molHI,相当于增大压强,平衡不移动,HI转化率不变,HI转化率=1-0.784=0.216=21.6%,故D正确;
故选C.
点评 本题考查化学平衡计算,侧重考查学生分析计算能力,明确化学平衡常数表达式、压强对化学平衡移动影响是解本题关键,注意该反应前后气体物质的量之和不变,压强不影响平衡移动,易错选项是C.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | A的质量分数增加 | B. | 平衡不移动 | ||
| C. | 化学计量数:m+n=3 | D. | 物质C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.36×10-5 mol•L-1 | B. | 8.90×10-6 mol•L-1 | ||
| C. | 4.45×10-2 mol•L-1 | D. | 1×10-5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
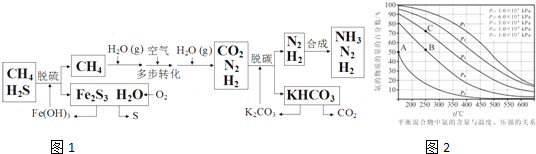
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
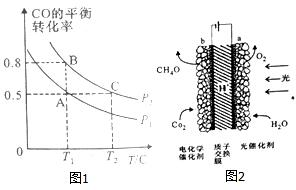 N、C、S元素的单质及化合物在工农业生成中有着重要的应用
N、C、S元素的单质及化合物在工农业生成中有着重要的应用| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
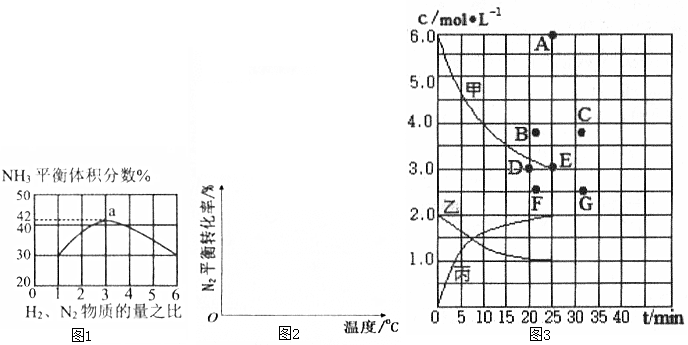
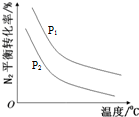
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| N(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
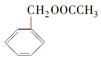 )是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图: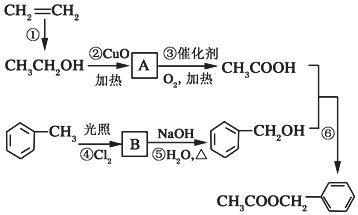
 ;
; ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com