



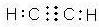



·ÖĪö ÓÉŠÅĻ¢I¼°YµÄ½į¹¹£¬ÄęĶĘæÉÖŖGĪŖ
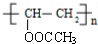 £®ÓÉNµÄ·Ö×ÓŹ½æÉÖŖ£¬ŅŅĖįÓėM·¢Éśõ„»Æ·“Ӧɜ³ÉN£¬¹ŹMµÄ·Ö×ÓŹ½ĪŖ£ŗC12H16O2+H2O-C2H4O2=C10H14O£¬¶ųNµÄ·Ö×ÓÖŠŗ¬ÓŠ3øö¼×»ł£¬¹ŹMÖŠŗ¬ÓŠ2øö¼×»ł£¬½įŗĻŠÅĻ¢IIæÉÖŖ£¬KĪŖ
£®ÓÉNµÄ·Ö×ÓŹ½æÉÖŖ£¬ŅŅĖįÓėM·¢Éśõ„»Æ·“Ӧɜ³ÉN£¬¹ŹMµÄ·Ö×ÓŹ½ĪŖ£ŗC12H16O2+H2O-C2H4O2=C10H14O£¬¶ųNµÄ·Ö×ÓÖŠŗ¬ÓŠ3øö¼×»ł£¬¹ŹMÖŠŗ¬ÓŠ2øö¼×»ł£¬½įŗĻŠÅĻ¢IIæÉÖŖ£¬KĪŖ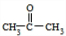 £¬MĪŖ
£¬MĪŖ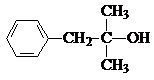
 £¬¾Ż“Ė½ā“š£®
£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗÓÉŠÅĻ¢I¼°YµÄ½į¹¹£¬ÄęĶĘæÉÖŖGĪŖ
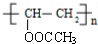 £®ÓÉNµÄ·Ö×ÓŹ½æÉÖŖ£¬ŅŅĖįÓėM·¢Éśõ„»Æ·“Ӧɜ³ÉN£¬¹ŹMµÄ·Ö×ÓŹ½ĪŖ£ŗC12H16O2+H2O-C2H4O2=C10H14O£¬¶ųNµÄ·Ö×ÓÖŠŗ¬ÓŠ3øö¼×»ł£¬¹ŹMÖŠŗ¬ÓŠ2øö¼×»ł£¬½įŗĻŠÅĻ¢IIæÉÖŖ£¬KĪŖ
£®ÓÉNµÄ·Ö×ÓŹ½æÉÖŖ£¬ŅŅĖįÓėM·¢Éśõ„»Æ·“Ӧɜ³ÉN£¬¹ŹMµÄ·Ö×ÓŹ½ĪŖ£ŗC12H16O2+H2O-C2H4O2=C10H14O£¬¶ųNµÄ·Ö×ÓÖŠŗ¬ÓŠ3øö¼×»ł£¬¹ŹMÖŠŗ¬ÓŠ2øö¼×»ł£¬½įŗĻŠÅĻ¢IIæÉÖŖ£¬KĪŖ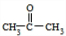 £¬MĪŖ
£¬MĪŖ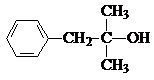
 £¬
£¬
£Ø1£©AĪŖCH”ŌCH£¬AµÄµē×ÓŹ½ĪŖ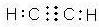 £¬
£¬
¹Ź“š°øĪŖ£ŗ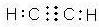 £»
£»
£Ø2£©DĪŖCH3CH=CHCHO£¬ŌņHĪŖCH3CH=CHCOOH£¬ŌŚŅ»¶ØĢõ¼žĻĀCH3CH=CHCOOH·¢Éś¼Ó¾Ū·“Ӧɜ³ÉøßĪüĖ®ŠŌŹ÷Ö¬I£¬H”śIµÄ»Æѧ·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø3£©DĪŖCH3CH=CHCHO£¬ĘäÖŠĢ¼Ģ¼Ė«¼ü”¢Ģ¼ŃõĖ«¼üÉĻµÄĖłÓŠŌ×Ó¶¼æÉŅŌ¹²Ćę£¬µ„¼üæÉŅŌ×Ŗ¶Æ£¬ĖłŅŌD·Ö×ÓÖŠ×ī¶ąÓŠ9øöŌ×Ó¹²Ćę£¬
¹Ź“š°øĪŖ£ŗ9£»
£Ø4£©D”śEµÄ»Æѧ·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø5£©M”śNµÄ»Æѧ·½³ĢŹ½ĪŖ £¬
£¬
¹Ź“š°øĪŖ£ŗ £»
£»
£Ø6£©ÓėB£ØCH3COOCH=CH2£©ÓŠĻąĶ¬µÄ¹ŁÄÜĶŵÄĶ¬·ÖŅģ¹¹ĢåĪŖCH2=CHCOOCH3”¢HCOOCH=CHCH3£ØÓŠĖ³”¢·“Į½ÖÖ£©”¢HCOOCH2CH=CH2£¬¹²4ÖÖ£¬
¹Ź“š°øĪŖ£ŗ4£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļĶʶĻ£¬ŠčŅŖѧɜ¶ŌøųÓčµÄŠÅĻ¢½ųŠŠĄūÓĆ£¬½ĻŗƵÄæ¼²éѧɜ×ŌѧÄÜĮ¦”¢ĒØŅĘŌĖÓĆÄÜĮ¦”¢·ÖĪöĶĘĄķÄÜĮ¦£¬³ä·ÖĄūÓĆ×Ŗ»Æ¹ŲĻµÖŠÓŠ»śĪļµÄ½į¹¹”¢·Ö×ÓŹ½Óė·“Ó¦Ģõ¼ž½ųŠŠĶʶĻ£¬ŠčŅŖѧɜŹģĮ·ÕĘĪÕ¹ŁÄÜĶŵĊŌÖŹÓė×Ŗ»Æ£¬ÄѶČÖŠµČ£®


 ÓÅŠćÉśæģĄÖ¼ŁĘŚĆæŅ»ĢģČ«ŠĀŗ®¼Ł×÷Ņµ±¾ĻµĮŠ“š°ø
ÓÅŠćÉśæģĄÖ¼ŁĘŚĆæŅ»ĢģČ«ŠĀŗ®¼Ł×÷Ņµ±¾ĻµĮŠ“š°ø Źī¼Ł½ÓĮ¦ČüŠĀ½®ĒąÉŁÄź³ö°ęÉēĻµĮŠ“š°ø
Źī¼Ł½ÓĮ¦ČüŠĀ½®ĒąÉŁÄź³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ō×Ó¼äµÄĻą»„×÷ÓĆ³ĘĪŖ»Æѧ¼ü | |
| B£® | ĘĘ»µ¾É»Æѧ¼ü£¬ŠčŅŖ·Å³öŅ»¶ØµÄÄÜĮæ | |
| C£® | ŌŚ»Æѧ·“Ó¦ÖŠ²»½öÓŠĪļÖŹµÄ±ä»Æ£¬»¹°éĖę×ÅÄÜĮæµÄ±ä»Æ | |
| D£® | ČĖĆĒĄūÓĆ»Æѧ·“Ó¦£¬Ö»ŹĒĪŖĮĖÖĘČ”ĖłŠčŅŖµÄĪļÖŹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪļÖŹµÄĮæÅضČĻąĶ¬µÄĮ½ÖÖČÜŅŗµÄPH£ŗNaHCO3£¾Na2CO3 | |
| B£® | ÓėÅضČĻąĶ¬µÄŃĪĖįČÜŅŗ·“Ó¦²śÉśĘųĢåµÄĖŁĀŹ£ŗNaHCO3£¼Na2CO3 | |
| C£® | ĻąĶ¬ĪĀ¶ČŹ±ŌŚĖ®ÖŠµÄČܽāŠŌ£ŗNaHCO3£¾Na2CO3 | |
| D£® | ČČĪČ¶ØŠŌ£ŗNaHCO3£¼Na2CO3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚÓƶžŃõ»ÆĆĢŗĶÅØŃĪĖįÖĘĀČĘųŹ±£¬¼ÓČė¶žŃõ»ÆĆĢŗóÓ¦Ź×ĻȵćČ¼¾Ę¾«µĘ¼ÓČČ£¬Č»ŗóÖšµĪ¼ÓČėÅØŃĪĖį | |
| B£® | Ź¹ÓĆĖ®ŅųĪĀ¶Č¼Ę²āĮæÉÕ±ÖŠµÄĖ®Ō”ĪĀ¶ČŹ±£¬²»É÷“ņĘĘĖ®ŅųĒņ£¬ÓƵĪ¹Ü½«Ė®ŅųĪü³ö·ÅČėĖ®·āµÄŠ”ĘæÖŠ£¬²ŠĘʵÄĪĀ¶Č¼Ę²åČė×°ÓŠĮņ·ŪµÄ¹ćæŚĘæÖŠ | |
| C£® | ÓĆŹŌ¹Ü¼Š“ÓŹŌ¹Üµ×ÓÉĻĀĶłÉĻ¼Š×”¾ąĄė¹ÜæŚŌ¼$\frac{2}{3}$“¦£¬ŹÖ³ÖŹŌ¹Ü¼Š³¤±śÄ©¶Ė£¬½ųŠŠ¼ÓČČ | |
| D£® | Õō·¢ČÜŅŗŹ±ÓŠŅŗĢå·É½¦£¬Ó¦Į¢¼“¼ÓĖ®ĄäČ“ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 mol FeÓė×ćĮæĻ”ŃĪĖį·“Ó¦Ź±£¬×ŖŅʵē×ӵďżÄæĪŖ3 NA | |
| B£® | ±ź×¼×“æöĻĀ£¬22.4 LĖ®ÖŠŗ¬ÓŠĖ®·Ö×ӵďżÄæĪŖNA | |
| C£® | 14 g N2ÖŠŗ¬ÓŠµē×ӵďżÄæĪŖ7 NA | |
| D£® | ŹżÄæĪŖNAµÄŅ»Ńõ»ÆĢ¼·Ö×ÓŗĶ0.5 mol¼×ĶéµÄÖŹĮæ±ČĪŖ7£ŗ4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚäåĖ®ÖŠ“ęŌŚČēĻĀĘ½ŗā£ŗBr2+H2O?HBr+HBrO£¬µ±¼ÓČėNaOHČÜŅŗŗóŃÕÉ«±äĒ³ | |
| B£® | ¶Ō2NO2£Øg£©?N2O4£Øg£© Ę½ŗāĢåĻµ£¬Ōö¼ÓŃ¹ĒæŹ¹ŃÕÉ«±äĒ³ | |
| C£® | ·“Ó¦CO+NO2?CO2+NO”÷H£¼0ÉżøßĪĀ¶ČŹ¹Ę½ŗāĻņÄę·½ĻņŅĘ¶Æ | |
| D£® | ĻņĖ«ŃõĖ®ČÜŅŗÖŠµĪČėFeCl3 ČÜŅŗŗ󣬲śÉśĘųÅŻĖŁĀŹ¼Óæģ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ${\;}_{8}^{16}$O2ŗĶ${\;}_{8}^{18}$O2»„ĪŖĶ¬Ī»ĖŲ£¬ŠŌÖŹĻąĖĘ | |
| B£® | Ģś·ÅČėĻ”ĮņĖįÖŠ£¬ŌŁ¼ÓČėĻõĖįÄĘæÉŅŌ¼Óæģ·Å³öĒāĘųµÄĖŁĀŹ | |
| C£® | Ć÷·ÆŗĶĘÆ°×·Ū³£ÓĆÓŚ×ŌĄ“Ė®¾»»ÆŗĶɱ¾śĻū¶¾£¬Į½Õß×÷ÓĆŌĄķĻąĶ¬ | |
| D£® | C£ØŹÆÄ«£¬s£©=C£Ø½šøÕŹÆ£¬s£©”÷H£¾0£¬ĖłŅŌŹÆÄ«±Č½šøÕŹÆĪČ¶Ø |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com