
| 10.7g |
| 107g/mol |


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
| A、能与金属钠反应放出氢气 |
| B、能与溴水发生取代反应而使溴水褪色 |
| C、能使酸性高锰酸钾溶液褪色 |
| D、不能与新制氢氧化铜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属键、离子键、分子间作用力都没有方向性和饱和性 |
| B、键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱 |
| C、离子键、金属键、氢键、范德华力本质上都是静电作用 |
| D、乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
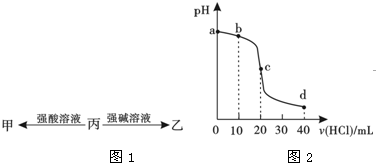
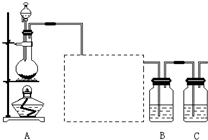 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
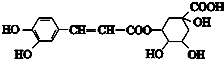 绿原酸在药物、食品保健、化妆品行业有广泛用途,能有效清除人体内自由基、抗氧化、抗衰老,还能降血压,对心血管有保护作用.其结构简式如图,下列有关绿原酸的说法不正确的是( )
绿原酸在药物、食品保健、化妆品行业有广泛用途,能有效清除人体内自由基、抗氧化、抗衰老,还能降血压,对心血管有保护作用.其结构简式如图,下列有关绿原酸的说法不正确的是( )| A、属于芳香族化合物,分子有4种官能团 |
| B、能与Na2CO3、NaHCO3、FeCl3溶液反应 |
| C、0.1mol绿原酸最多与0.8mol NaOH反应 |
| D、绿原酸有还原性,能发生取代反应、消去反应、加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com