
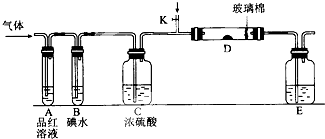
 某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.分析 (1)SO2具有漂白性,Cl2与水反应生成的HClO具有漂白性;
(2)设碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得:a=+5,所以碘单质被氧化为HIO3,据此书写方程式;
(3)E装置中以NaOH溶液吸收尾气二氧化碳,NaOH可能过量,或亚硫酸钠被氧化.
解答 解:(1)二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色,
故答案为:相同;
(2)若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量Cl2完全反应后,转移的电子为5.0×10-5mol,令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10-3L×1.0×10-3mol/L×2×a=5.0×10-5mol,解得a=+5,所以碘单质被氧化为HIO3,则该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(3)E装置中以NaOH溶液吸收尾气二氧化碳,NaOH可能过量,反应生成Na2SO3,且Na2SO3可能被氧化为Na2SO4,则实验结束后,E装置中可能含有的溶质为NaOH、Na2SO3、Na2SO4,
故答案为:NaOH、Na2SO3、Na2SO4.
点评 本题考查了氯气的性质及实验分析,为高频考点,涉及离子方程式书写、性质实验方案的设计与评价等知识点,试题有利于培养学生的分析、理解能力及化学实验能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 金属钠加入水中:Na+H2O=Na++OH-+H2↑ | |
| B. | 碳酸氢钙溶液跟氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O | |
| C. | 氢氧化钡溶液滴入硫酸氢钠溶液至中性:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| D. | 亚硫酸钠和足量的稀硝酸混合:SO32-+2H+=SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
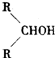 最难
最难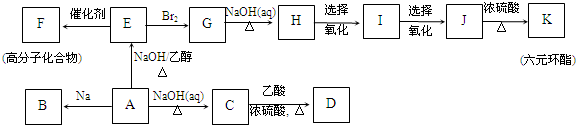
 ,K为
,K为 ;
;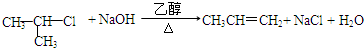 ;G→H
;G→H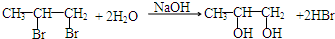 ;
;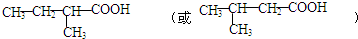 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
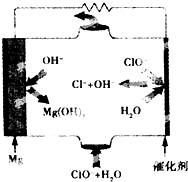 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运及污染小等特点.如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是( )| A. | 池总反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl- | |
| B. | 正极反应式为ClO-+H2O+2e-=Cl-+2OH- | |
| C. | 该燃料电池中镁为负极,发生还原反应电 | |
| D. | 放电过程中OH-移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1>V2 | B. | V1<V2 | C. | V1=V2 | D. | V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水来吸收氯气:Cl2+OH-═Cl-+ClO-+H+ | |
| B. | 将金属Na加入冷水中:Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3═3Fe2++2NO↑+4H2O | |
| D. | 碳酸氢钙溶液中加入少量苛性钾溶液:OH-+Ca2++HCO3-=H2O+CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA | |
| B. | 1 mol Al3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| C. | 常温常压下,32 g O2-中所含电子的数目为17NA | |
| D. | 标准状况下,11.2 L苯中含有分子的数目为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com