
【题目】下列有关实验装置的说法中正确的是( )
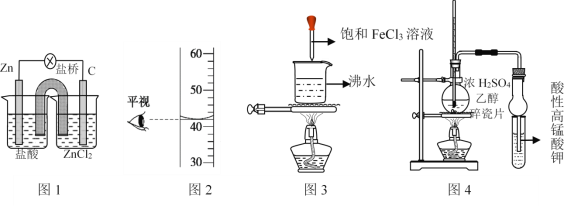
A.用图1装置可以实现化学能持续转化为电能
B.放出图2装置中全部液体,体积为42.00 mL
C.用图3装置可以制备少量氢氧化铁胶体
D.用图4装置可以检验乙醇脱水后有乙烯生成
【答案】C
【解析】
A.要实现化学能持续转化为电能,应该把Zn电极放入ZnCl2溶液中,把石墨电极放入盐酸中,A错误;
B.图示的仪器小刻度在下,大刻度在上,表示的是量筒,精确度是0.1 mL,不能精确到0.01 mL,因此放出图2装置中全部液体,体积为42.0 mL,B错误;
C.氢氧化铁胶体的制取方法是:向沸腾的蒸馏水中滴加几滴饱和氯化铁饱和溶液,继续加热液体呈红褐色,停止加热,得到的红褐色液体就是氢氧化铁胶体,C正确 ;
D.乙醇易挥发,乙醇能被酸性高锰酸钾溶液氧化而使溶液褪色,同时乙醇与浓硫酸发生氧化还原反应生成的二氧化硫也能使酸性高锰酸钾溶液褪色,因此不能确定是否产生了乙烯,D错误;
故合理选项是C。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】在8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O反应中
(1)在上述化学方程式中用双线桥标明电子转移的方向和数目________。
(2)___发生了氧化反应,____是氧化剂。(填元素符号或化学式)
(3)上述反应中,还原剂和氧化剂的物质的量之比是___________;若生成1mol气体,则转移的电子数是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在室温下有以下平衡:
编号 | 平衡方程式 | 平衡常数 |
① | HCNH++CN- | Ka=1×10-10 |
② | H2OH++OH- | Kw=1×10-14 |
③ | CN-+H2OHCN+OH- | K=? |
则下列判断错误的是
A.①的ΔS>0, ΔH>0
B.用标准NaOH溶液滴定浓度约为0.01molL-1HCN,可用甲基橙做指示剂
C.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH溶液,则该溶液呈碱性
D.0.2molL-1的HCN溶液中加入等体积的0.1molL-1NaOH所得的混合溶液中:2c(H+)+c(HCN)=2c(OH-)+c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.若增大CO的浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D. c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)已知在448 ℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为______;反应
H2(g)+I2(g)的平衡常数K2为______;反应![]() H2(g)+
H2(g)+![]() I2(g)
I2(g)![]() HI(g)的平衡常数K3为________。
HI(g)的平衡常数K3为________。
(II)在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____。
(2)该反应为_____(填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为_____℃。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol·L1,c(H2)=1.5mol·L1,c(CO)=1mol·L1,c(H2O)=3mol·L1,则下一时刻,反应向_____(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
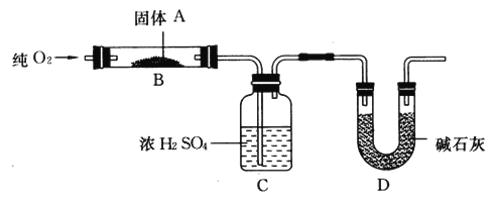
取17.1 g A放入B装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(1)通入过量O2的目的是________。
(2)C装置的作用是________;D装置的作用是________。
(3)通过该实验,能否确定A中是否含有氧元素? ___________________。
(4)若A的摩尔质量为342 g/mol,C装置增重9.9 g,D装置增重26.4 g,则A的分子式为_____。
(5)写出A燃烧的化学方程式:__________________。
(6)A可发生水解反应,1 mol A可水解生成2 mol同分异构体,则A在催化剂作用下水解的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.向0.1mol·L-1的CH3COONa溶液中通入HCl气体至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)
B.相同浓度的CH3COONa和HCOONa的混合溶液中:c(Na+)>c(HCOO-)>c(CH3COO-)>c(OH-)
C.c(NH![]() )相等的HCOONH4溶液、CH3COONH4溶液:c(HCOONH4)>c(CH3COONH4)
)相等的HCOONH4溶液、CH3COONH4溶液:c(HCOONH4)>c(CH3COONH4)
D.0.1mol·L-1的CH3COOH溶液和0.05mol·L-1的NaOH溶液等体积混合:c(Na+)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气体的摩尔质量为Mg/mol,现有该气体mg, 用NA表示阿伏加德罗常数,求下列量:
①该气体的物质的量为______________mol;
②该气体在标准状况下的体积为_________________L;
③该气体在标准状况下的密度为_________________g/L;
④该气体一个分子的质量为_________________g;
⑤该气体m g完全溶解于水(气体与水不反应),得到100mL溶液,所得溶液的物质的量浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥分析下列氧化还原反应,并按要求填空。2Al+3H2SO4 =Al2(SO4)3+3H2↑_______
(1)氧化剂:________,氧化产物:________;
(2)标准状况下,生成3.36L H2,参加反应的Al的质量是_______,转移的电子的物质的量为_____,若溶液中H2SO4的物质的量浓度为1.5 mol/L,则恰好完全反应需加入的H2SO4溶液的体积_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com