
| A. | SiCl4是分子晶体 | B. | 单质B是原子晶体 | C. | AlCl3是离子晶体 | D. | MgCl2离子晶体 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | CaCO3跟稀硫酸反应:CaCO3+H++SO42-═CaSO4+H2O+CO2↑ | |
| D. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ③④⑥⑦ | C. | ①②⑥⑦ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
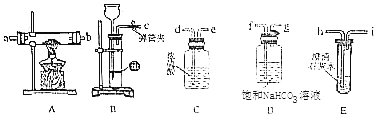
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 180 | $\frac{2}{3}$ | 0.1 |
| 2 | n | $\frac{2}{3}$ | 5 |
| 3 | 350 | m | 5 |
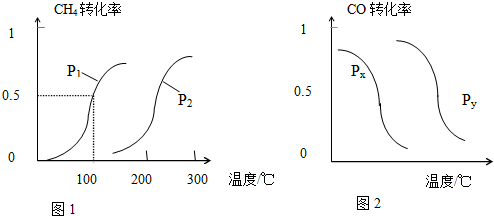
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压下,相同体积的任何气体单质所含的分子数目一定相同 | |
| B. | 1L 0.5mol/L FeCl3溶液完全转化可得0.5NA个Fe(OH)3胶粒 | |
| C. | 标准状况下,22.4L苯含有的分子数为1NA | |
| D. | 在常温常压下,11.2 L氮气所含的原子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com