
| A����10 NA������ת��ʱ���÷�Ӧ�ų�1300kJ������ |
| B����1 NA��ˮ����������ΪҺ��ʱ������1300kJ������ |
| C����2 NA��̼�����õ��Ӷ�����ʱ���ų�1300kJ������ |
| D����8 NA��̼�����õ��Ӷ�����ʱ���ų�1300kJ������ |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
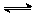 2SO3��������2 mol SO3ʱ�ų�����ΪQ���ֽ�1 mol SO2��0.5 mol O2����ͬ�����·�Ӧ����SO3�ų�������ΪQ1���� ��
2SO3��������2 mol SO3ʱ�ų�����ΪQ���ֽ�1 mol SO2��0.5 mol O2����ͬ�����·�Ӧ����SO3�ų�������ΪQ1���� ��| A��Q1 <1/2Q | B��Q1 = 1/2Q | C��2Q1 > Q | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���÷�Ӧ��������ԭ�� |
| B��Һ̬�µ�ȼ����Ϊ20.05 kJ��mol��1 |
| C���ö���Դ��ͻ���ŵ�֮һ��������Ի�����ȾС |
| D���º������ⷴӦ���Ȼ�ѧ����ʽΪ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2NH3�������仯��ͼ��ʾ��д�����ɰ���ʱ�÷�Ӧ���Ȼ�ѧ����ʽ ��
2NH3�������仯��ͼ��ʾ��д�����ɰ���ʱ�÷�Ӧ���Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
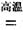 TiCl4+2CO
TiCl4+2CO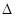 H����393��5 kJ��mol-1
H����393��5 kJ��mol-1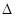 H��-566 kJ��mol-1
H��-566 kJ��mol-1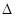 H��+141 kJ��mol-1
H��+141 kJ��mol-1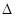 H�� ��
H�� ��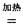 4NaCl+Ti���÷�Ӧ������ˮ��Һ�н��У�һ����ΪTiCl4��ǿ��ˮ������TiO2����һԭ�� �����ʵ���ѧ����ʽ���Ա�Ҫ������˵������
4NaCl+Ti���÷�Ӧ������ˮ��Һ�н��У�һ����ΪTiCl4��ǿ��ˮ������TiO2����һԭ�� �����ʵ���ѧ����ʽ���Ա�Ҫ������˵������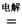 Mg+Cl2 TiCl4+2Mg
Mg+Cl2 TiCl4+2Mg 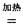 2MgCl2+Ti
2MgCl2+Ti ��ʹ��ʱ�ȳ�磬д������ʽ��������Ӧ ���ŵ�ʱLi+���ƶ����� ��
��ʹ��ʱ�ȳ�磬д������ʽ��������Ӧ ���ŵ�ʱLi+���ƶ����� ���鿴�𰸺ͽ���>>
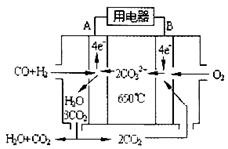
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Ni(CO)4(g)���÷�Ӧ�ġ�H______0 (ѡ�������������)��
Ni(CO)4(g)���÷�Ӧ�ġ�H______0 (ѡ�������������)�� ���¶�(t)�Ĺ�ϵ����ͼ����һ����̼��ԭ����������Ӧ�Ļ�ѧƽ�ⳣ������ʽ�ɱ�ʾΪ��K��______________��800��ʱ���������ױ���ԭ�Ľ�����������___________���÷�Ӧ��ƽ�ⳣ����ֵ(K)����__________��
���¶�(t)�Ĺ�ϵ����ͼ����һ����̼��ԭ����������Ӧ�Ļ�ѧƽ�ⳣ������ʽ�ɱ�ʾΪ��K��______________��800��ʱ���������ױ���ԭ�Ľ�����������___________���÷�Ӧ��ƽ�ⳣ����ֵ(K)����__________��
 CH3OH(g) ��H����90.7 kJ��mol��1
CH3OH(g) ��H����90.7 kJ��mol��1 CH3OCH3(g)��H2O(g) ��H����23.5 kJ��mol��1
CH3OCH3(g)��H2O(g) ��H����23.5 kJ��mol��1 CO2(g)��H2(g) ��H����41.2 kJ��mol��1
CO2(g)��H2(g) ��H����41.2 kJ��mol��1 CH3OCH3(g)��CO2(g)�ġ�H��_______________��
CH3OCH3(g)��CO2(g)�ġ�H��_______________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��


A����101Kpaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8KJ����������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2(g)=2H2O(l) ��H= +285.8KJ/mol | B����֪C��ʯī��s�� C�����ʯ��s�� ��H>0����ʯī�Ƚ��ʯ�ȶ� C�����ʯ��s�� ��H>0����ʯī�Ƚ��ʯ�ȶ� | C����ϡ��Һ��H��(aq)��OH��(aq)  H2O(l) ��H����57.2 kJ/mol�� ������0.5 mol H2SO4��Ũ�����뺬1 mol NaOH��ϡ��Һ��ϣ��ų�����������57.2 kJ H2O(l) ��H����57.2 kJ/mol�� ������0.5 mol H2SO4��Ũ�����뺬1 mol NaOH��ϡ��Һ��ϣ��ų�����������57.2 kJ | D����֪2H2��g��+O2��g�� 2H2O��l�� ��H1 , 2H2O��l�� ��H1 ,  2H2��g��+O2��g�� 2H2��g��+O2��g�� 2H2O��g�� ��H2 ,�� ��H1 > ��H2 2H2O��g�� ��H2 ,�� ��H1 > ��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��561 kJ�qmol-1 | B��-93 kJ�qmol-1 | C��-561 kJ�qmol-1 | D��+93kJ�qmol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com