
| 化学键 | C-H | C-F | H-F | F-F |
| 键能/(kJ•mol-1) | 414 | 489 | 565 | 155 |
| A. | +1940 kJ•mol-1 | B. | -1940 kJ•mol-1 | C. | -485 kJ•mol-1 | D. | +485 kJ•mol-1 |
科目:高中化学 来源: 题型:解答题
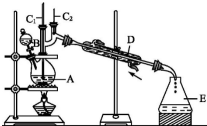 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
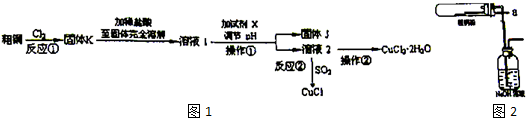
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
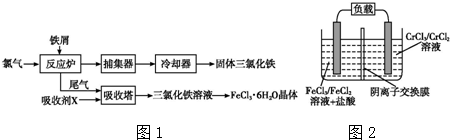
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
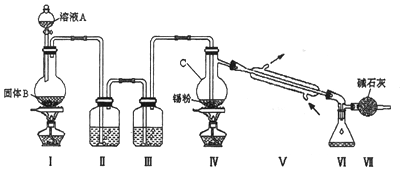
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的CO2通入NaClO溶液中发生反应:NaClO+CO2+H2O=NaHCO3+HClO,说明酸性强弱的顺序为H2CO3>HClO>HCO3- | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4具有强氧化性,常温下就能与金属Cu发生剧烈反应 | |
| D. | NO2与H2O 反应的过程中,被氧化的氮原子与被还原的氮原子的个数比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com