
| A. | CH3OH | B. | C(CH3)4 | C. | CH3COOH | D. | CH3COOCH3 |
科目:高中化学 来源: 题型:填空题
| 变化 | △H | △S | 方向性 |
| H2O(l)→H2O(g) | |||
| CaO(s)+SO2(g)═CaSO3(s) | |||
| 2Fe3+(aq)+Cu(s)═2Fe2+(aq)+Cu2+(aq) | |||
| NH4Cl(s)═HCl(g)+NH3(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应都伴随着能量变化 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在吸热反应中,反应物的总能量高于生成物的总能量 | |
| D. | 需要加热的化学反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步 HSO4-?H++SO42- | 10% |
| B | 硫酸氢钠溶液:HSO4-?H++SO42 | 29% |
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% |
| D | 盐酸:HCl=H++Cl- | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{b}^{a}R$ | B. | ${\;}_{a-2}^{a+b-2}R$ | C. | ${\;}_{a+2}^{a+b+2}R$ | D. | ${\;}_{a-2}^{a+b}R$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
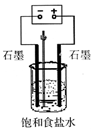 (1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
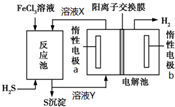 利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示.下列有关的说法错误的是( )| A. | 惰性电极a为发生氧化反应 | |
| B. | Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解 | |
| C. | 溶液Y加热蒸发灼烧最终得到Fe2O3 | |
| D. | 电解池总反应的离子方程式为2Fe2++2H+$\frac{\underline{\;电解\;}}{\;}$2Fe3++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com