
| A. | ①③⑤ | B. | ②④ | C. | ②⑤ | D. | ③④⑤ |
分析 ①H2S和S02反应生成硫沉淀;②S02和SO3不反应;③SO2和氯水生成硫酸和HCl;④S03(气)和C12不反应;⑤H2S和C12生成单质硫和HCl,据此分析.
解答 解:①H2S和S02反应生成硫沉淀,所以有明显现象;
②S02和SO3不反应,没有明显现象;
③SO2和氯水生成硫酸和HCl,氯水的浅黄绿色褪去,所以有明显现象;
④S03(气)和C12不反应,没有明显现象;
⑤H2S和C12生成单质硫和HCl,有浅黄色沉淀生成,所以有明显现象;
符合题意的是②④;
故选B.
点评 本题考查了硫及其化合物的性质,题目难度不大,侧重于考查元素化合物的性质,注意把握有关物质之间的反应.


科目:高中化学 来源: 题型:解答题
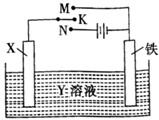 高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3+3CO(g)?2Fe(s)+3CO2(g)△H=akJ•mol-1| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度 物质的量 时间 | 2min | 4min | 6min | 8min | 10min | 12min |
| 450℃ | 0.2mol | 0.3mol | 0.35mol | 0.40mol | 0.50mol | 0.50mol |
| 480℃ | 0.25mol | 0.35mol | 0.45mol | 0.60mol | 0.60mol | 0.60mol |
| A. | 该反应是熵增,焓增的反应,在较高温度下能自发进行 | |
| B. | 恒温恒压,达到新平衡时,c(CO2)不变,c(MgCO3)增大 | |
| C. | 在2~8min之间CO2平均速率v(CO2)=$\frac{1}{30}$mol•L-1•min-1 | |
| D. | 升高温度,该反应平衡常数、分解速率和MgCO3分解率都增大. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
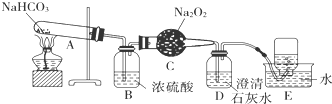
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
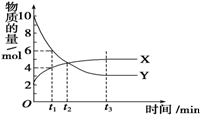 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )| A. | 反应的化学方程式为7Y?3X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,反应达到平衡状态,正、逆反应速率相等 | |
| D. | t3时,反应达到平衡状态,逆反应速率等于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量(mol) | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 46.3kJ |
| ② | 0.6 | 1.8 | 0.8 | Q (Q>0) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 | B. | 3.36 | C. | 4.48 | D. | 1.12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com