
【题目】化学与社会、生产和生活息息相关。下列说法不正确的是 ( )
A.硅太阳能电池与原电池的原理不同
B.铵态氮肥和草木灰混合使用可增加肥效
C.用可溶性的铝盐和铁盐处理水中的悬浮物
D.硫酸工业中使用过量的空气以提高二氧化硫的利用率
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.比例模型![]() :可以表示二氧化碳分子,也可以表示水分子
:可以表示二氧化碳分子,也可以表示水分子
B.室温下,将![]() HA溶液和
HA溶液和![]() 溶液等体积混合
溶液等体积混合![]() 忽略混合时溶液体积的变化
忽略混合时溶液体积的变化![]() 测得混合溶液的
测得混合溶液的![]() ,则混合溶液中由水电离出的
,则混合溶液中由水电离出的![]()
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于![]() 时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素
时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]()
![]() 的
的![]() 溶液和
溶液和![]()
![]() 溶液混合,不会有
溶液混合,不会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中正确的是( )
A.常温下,pH=4的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-)
B.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
C.已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)<K(HCN)
D.0.1mol/L醋酸溶液加少量水稀释![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测量碳铁合金的含碳量,提出了如下三种实验方案。
方案Ⅰ:含碳铁合金粉末与浓硫酸在一定条件下反应,用下列装置![]() 加持装置省略
加持装置省略![]() 既可检验产物中除
既可检验产物中除![]() 外混合气体的成分,又可通过测量
外混合气体的成分,又可通过测量![]() 的质量来计算合金的含碳量。
的质量来计算合金的含碳量。

(1)合金与浓硫酸在一定条件下生成![]() 的反应中,做还原剂的物质时____(填化学式)。
的反应中,做还原剂的物质时____(填化学式)。
(2)为实现实验目的,上述仪器正确的连接顺序![]() 按气流方向
按气流方向![]() 为:混合气体→____→____→______→(a)(b)→_____→_______→(k)(l)。
为:混合气体→____→____→______→(a)(b)→_____→_______→(k)(l)。
(3)装置E中所装药品为 ______ ![]() 填字母序号
填字母序号![]() ;在本实验中的作用是 ______ 。
;在本实验中的作用是 ______ 。
A 碱石灰 B 无水氯化钙 C 浓硫酸
(4)若能观察到 ______ 的现象,则证明原混合气体中一定含有![]() 。
。
(5)实验后最终测量的含碳量偏低,某同学猜测混合气体中有可能含有CO,在G后增加一个装置即可验证他的猜测,请简要说明验证这个猜测所需装置及药品和具体实验现象 ______ 。
方案Ⅱ:称取粉末状样品![]() ,加入某浓度的稀硫酸100mL,充分反应后,收集到标准状况下气体
,加入某浓度的稀硫酸100mL,充分反应后,收集到标准状况下气体![]() ,然后继续往样品中加入同浓度的稀硫酸100mL,充分反应后又收集到标准状况下气体1.12L。则合金中碳的质量分数为 ______(保留三位有效数字)。
,然后继续往样品中加入同浓度的稀硫酸100mL,充分反应后又收集到标准状况下气体1.12L。则合金中碳的质量分数为 ______(保留三位有效数字)。
方案Ⅲ:利用灼烧法使合金中的碳转化为二氧化碳,合金质量会减轻从而计算含碳量,但是他们将一定量的样品灼烧后,发现质量反而增加了,其原因是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是有用的化工原料,回收利用
是有用的化工原料,回收利用![]() 既能减少大气污染,又能充分利用资源.有学者提出利用
既能减少大气污染,又能充分利用资源.有学者提出利用![]() 、
、![]() 等离子的作用,在常温下将
等离子的作用,在常温下将![]() 氧化成
氧化成![]() 而实现
而实现![]() 的回收利用.某研究性学习小组设计如图1下方案,在实验室条件下测定转化器的脱硫效率:
的回收利用.某研究性学习小组设计如图1下方案,在实验室条件下测定转化器的脱硫效率:
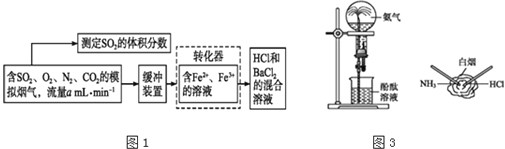
(1)写出![]() 将
将![]() 氧化成
氧化成![]() 的离子方程式______.
的离子方程式______.
(2)向滴有紫色石蕊溶液的试管中通入![]() 气体,现象是______,若再向其中滴入足量的氯水,现象是______,涉及反应的化学方程式有______.
气体,现象是______,若再向其中滴入足量的氯水,现象是______,涉及反应的化学方程式有______.
(3)图2甲是学过的验证铜与浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
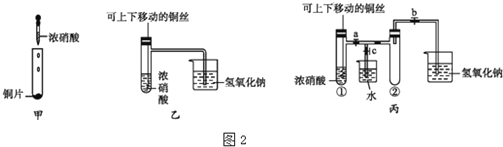
①甲、乙、丙3个装置中共同发生的反应的化学方程式是______,体现了浓硝酸的性质是______,往浅绿色的![]() 溶液中,逐滴加入稀盐酸时,溶液的颜色变化应是______
溶液中,逐滴加入稀盐酸时,溶液的颜色变化应是______
②和甲装置相比,乙装置的优点是______.
(4)图3所示是![]() 的两个性质实验,下列有关说法中正确的是______
的两个性质实验,下列有关说法中正确的是______
A.两个实验均表现了![]() 易溶于水
易溶于水
B.两个实验均表现了![]() 易挥发
易挥发
C.两个实验均表现了![]() 是碱性气体
是碱性气体
D.两个实验均表现了![]() 是还原性气体.
是还原性气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。

学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:______。
为了验证可能为甲,请完成下列实验方案。限选试剂:
a.98%的浓硫酸 b.1%的品红溶液 c.1.0 mol·L-1的KI-淀粉溶液
d.1.0 mol·L-1 的NaOH溶液 e.澄清石灰水 f.饱和NaCl溶液
所加试剂 | 预期现象和结论 |
试管A中加足量______(填序号); 试管B中加1%品红溶液; 试管C中加______(填序号)。 | 若A中________, B中________, C中________,则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度。
①在使用滴定管之前首先进行的操作是_____________________;
②量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;(反应的化学方程式为:NaClO + Na2SO3 = NaCl+ Na2SO4)将b mol·L-1的用硫酸酸化的KMnO4溶液装入_________(填仪器名称)中;滴定剩余的Na2SO3溶液,反应的化学方程式为:_______________。当溶液由__________(填滴定终点现象)停止滴定,记录数据。
③重复上述滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为_______mol·L-1(用含a、b、v1、v2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出有机物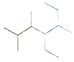 的名称____________________。
的名称____________________。
(2)分子式为C8H10属于芳香烃的同分异构体共有________种,其中________(结构简式)在苯环上的一氯代物有两种。
(3)有机物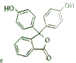 中含氧官能团的名称是____________________。
中含氧官能团的名称是____________________。
(4)分子式为C6H10的某烃是含有双键的链状结构,分子中无支链或侧链,且分子中不存在![]() 基团,则其可能的结构简式为____________________(任写一种)
基团,则其可能的结构简式为____________________(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是()
A.已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的ΔH=2×(-57.3)kJ·mol-1
B.将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g)ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH=-192.9kJ·mol-1,则CH3OH(g)的燃烧热为192.9kJ·mol-1
C.H2(g)的燃烧热为285.8kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6kJ·mol-1
D.葡萄糖的燃烧热是2800kJ·mol-1,则![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com