
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
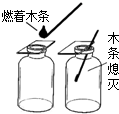 观察如图中的有关操作和现象,判断下列叙述正确的是( )
观察如图中的有关操作和现象,判断下列叙述正确的是( )| A、集气瓶中的气体可能是CO2 |
| B、集气瓶中的气体可能是空气 |
| C、集气瓶中的气体一定是O2 |
| D、集气瓶中的气体一定是N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH(aq) |
| △ |
| CO2 |
| O2/点燃 |
| H2O |
| 蒸干 |
| △ |
| HCl(aq) |
| △ |
| 石灰乳 |
| 煅烧 |
| A、①③⑤ | B、②③④ |
| C、②④⑤ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、达到平衡后,加入催化剂C%增大 |
| B、达到平衡后,若升温平衡向左移 |
| C、m+n<e+f |
| D、达平衡后,若降压平衡向左移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 摩尔质量(g/mol) | 278 | 140.6 | 413.6 |
| 密度(g/cm3) | 2.70 | 3.22 | 3.50 |
| A、钙长石生成 |
| B、镁橄榄石生成 |
| C、钙长石和镁橄榄石共存 |
| D、(钙镁)石榴子石生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫粉在过量的纯氧中燃烧可以生成大量的SO2 |
| B、可以用品红溶液鉴别SO2和CO2 |
| C、SO2能使品红溶液、酸性KMnO4溶液褪色,但褪色原理不同 |
| D、少量SO2通过CaCl2的溶液能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、原子半径由小到大的顺序为:Y<X<W<Z |
B、X元素最高价氧化物分子的比例模型为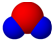 |
| C、Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 |
| D、W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com