
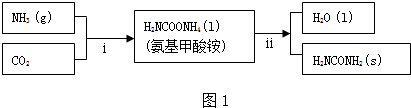

分析 (1)①题目所给的反应流程中物质状态和数据,可知2mol氨气与1molCO2完全反应生成最后产物放出能量为(272-138)kJ,然后写出热化学方程式;
②生成物为纯液体和纯固体,结合平衡常数的含义书写;
(2)①分析图2可知在10几分钟时NH3和CO2浓度不再变化,其他物质还在变化,说明反应ii更慢;
②因为反应为放热反应,升高温度,平衡逆移;
③因为NH3和CO2物质的量总和不变,增加一种反应物的量可以提高其他反应物转化率,由此可知随着n(NH3)/n(CO2)增大,NH3转化率减小,图中b为NH3转化率,由图上可知NH3转化率为80%,计算可知,平衡时NH3、CO2、CO(NH2)2、H2O物质的量分别为0.4mol、0.2mol、0.8mol、0.8mol;
④A.恒容时通入氦气不影响速率和平衡;
B.缩小体积可以加快速率促使平衡向右移动;
C.加入催化剂反应速率加快;
D.除去体系中的水蒸气减小反应速率,但平衡向右移动;
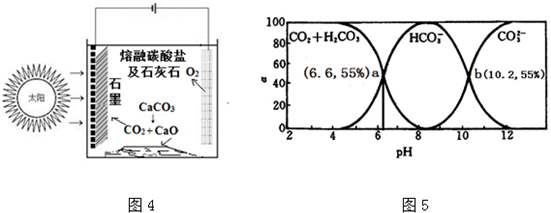
(3)①由图分析可知高温下CaCO3分解生成CaO、CO2,CO2参与阴极反应生成C,熔融的碳酸钠电解质电离出的CO32-离子在阴极上得电子产生O2;
②根据碳酸的Ka2=$\frac{[C{{O}_{3}}^{2-}][{H}^{+}]}{[HC{{O}_{3}}^{-}]}$,结合图象计算.
解答 解:(1)①题目所给的反应流程中物质状态和数据,可知2mol氨气与1molCO2完全反应生成最后产物放出能量为(272-138)kJ,则热化学方程式为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(l)△H=-134kJ/mol;
故答案为:2NH3(g)+CO(g)?CO(NH2)2(s)+H2O(l)△H=-134kJ/mol;
②总反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(l),则反应的平衡常数为K=$\frac{1}{{c}^{2}(N{H}_{3})•c(C{O}_{2})}$;
故答案为:$\frac{1}{{c}^{2}(N{H}_{3})•c(C{O}_{2})}$;
(2)①分析图2可知在10几分钟时NH3和CO2浓度不再变化,其他物质还在变化,说明反应ii更慢,所以反应ii决定总反应的速率;
故答案为:ii;
②因为该反应为放热反应,起始温度相同,在绝热容器中进行,反应体系温度上升,平衡逆移,K减少;
故答案为:减少;
③因为NH3和CO2物质的量总和不变,增加一种反应物的量可以提高其他反应物转化率,由此可知随着n(NH3)/n(CO2)增大,NH3转化率减小,图中b为NH3转化率.由图上可知NH3转化率为80%,计算可知,平衡时NH3、CO2、CO(NH2)2、H2O物质的量分别为0.4mol、0.2mol、0.8mol、0.8mol则CO(NH2)2的物质的量分数为$\frac{0.8mol}{0.2mol+0.4mol+0.8mol+0.8mol}$×100%=36.4%;
故答案为:36.4%;
④A.恒容时通入氦气不影响速率和平衡,反应各物质的浓度不变,反应速率不变,化学平衡不移动,尿素产率不变,故A不选;
B.缩小体积,压强增大,可以加快速率,促使平衡向右移动,故B选;
C.加入催化剂反应速率加快,化学平衡不移动,所以尿素产率不变,故C不选;
D.除去体系中的水蒸气减小反应速率,但平衡向右移,能提高尿素的产率,故D不选;
故答案为:B;
(3)①由图分析可知高温下CaCO3分解生成CaO、CO2,CO2参与阴极反应生成C,熔融的碳酸钠电解质电离出的CO32-离子在阴极上得电子产生O2,电极反应式为2CO32--4e-=2CO2↑+O2↑;
故答案为:2CO32--4e-=2CO2↑+O2↑;
②碳酸的Ka2=$\frac{[C{{O}_{3}}^{2-}][{H}^{+}]}{[HC{{O}_{3}}^{-}]}$,当[CO32-]=[HCO3-]时,Ka2=[H+],由图上曲线可知交点b为[CO32-]=[HCO3-],此处pH=10.2,即[H+]=10-10.2mol/L,则Ka2=10-10.2;故答案为:10-10.2.
点评 本题考查了热化学方程式的书写、影响反应速率和化学平衡的因素、化学平衡计算、电解原理的应用等,题目难度中等,侧重于考查学生的分析能力、计算能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的稀溶液混合,放出的热量等于57.3 kJ | |
| B. | 已知正丁烷(g)→异丁烷(g)△H<0,则正丁烷比异丁烷稳定 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物.综合治理其污染是环境化学当前的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C,B的平衡转化率不变 | |
| B. | 此时,B的平衡转化率是35% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molBr-完全转化为BrO3-,得到6 mol电子 | |
| B. | 该过程中溴化物发生氧化反应,臭氧发生还原反应 | |
| C. | 该过程中溴元素被还原,氧元素被氧化 | |
| D. | 该过程中臭氧(O3)是氧化剂,溴酸盐(BrO3-)是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com