
在25mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,
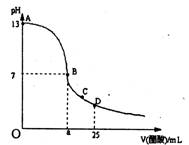
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式 _ ;
(2)该氢氧化钠溶液的物质的量浓度为 __mol?L―1;
(3)在B点,a ___12.5ml(填“大于”、“小于”或“等于”,下同)。若由体积相等的氢氧化钠和醋酸混合而且恰好呈中性,则混合前c(NaOH) __c(CH3COOH),混合前酸中 c (H+)和碱中c (OH-)的关系:c (H+) ____c (OH-)。
(4)在D点溶液中离子浓度大小关系为 __ 。
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 名称 | 性质 |
| 乙二醇 | 无色粘稠吸湿液体,易燃,沸点:196~198℃,与水混溶. |
| 丙酮 | 无色易燃液体,沸点:56.5℃,溶于水及大多数有机溶剂. |
| N,N二甲基甲酰胺(DMF) | 易燃,低毒,沸点:153℃,能与水和大多数有机溶剂混溶. |
| 对苯二甲酸(TPA) | 白色针状结晶或粉末,可燃,熔点:425℃(分解),约在300℃升华,不溶于水,微溶于热乙醇,溶于碱溶液.电离常数:Ka1=3.1×10-4,Ka2=1.5×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河北省高三下学期一调考试理综化学试卷(解析版) 题型:填空题
I? “套管实验”是将一支较小的玻璃仪器装入另外一个玻璃仪器中,经组装来完成原来需要更多仪器进行的实验。因其具有许多优点,被广泛应用于化学实验中,如图实验为“套管实验”,小试管内塞有沾有无水硫酸铜粉末的棉花球。请观察实验装置,分析实验原理,回答下列问题:
 ???
???
(1)该实验的目的是_____________________
(2)实验开始前微热试管,说明装置不漏气的现象是???????????????????????????????
(3)一段时间后结束实验,待装置冷却,取出小试管中固体溶于水,然后滴加1mol/L盐酸,产生CO2的量与盐酸的量的关系如图所示。其中合理的是________________

II燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池。氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料。请回答下列问题:
(1)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池。写出其正极反应式???
(2)以上述电池为电源,石墨为电极电解1L 0. 1mol/L的氯化钾溶液。回答下列问题:
写出电解总反应的离子方程式????????????????????? ???????????????

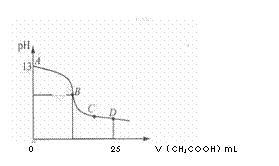
(3)室温时,电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸,加入醋酸的体积与溶液的pH的关系如图所示(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)
????????????? ①计算消耗标准状况下甲烷???????? mL
????????????? ②若图中的B点pH=7,则酸碱恰好完全反应的点在??????? 区间(填“AB”、“BC”或“CD”)
????????????? ③AB区间溶液中各离子浓度大小关系中可能正确的是?????????????????
A. c(K+)>c(OH-)>c (CH3COO-) >c(H+)???
B. c(K+)>c(CH3COO-)>c(OH-) >c(H+)
C. c(K+)>c(CH3COO-)=c(OH-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。

你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质。
丙同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
(4)探究氨水与盐酸的反应过程。
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图)。请回答:

①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3?H2O)+c(NH4+)=______mol?L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
【探究课题】比较在25℃、0.1mol?L-1的NH3?H2O溶液和0.1mol?L-1的NH4Cl溶液中,NH3?H2O的电离程度与NH4+水解程度的相对大小。
【探究方案】
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池是一种连续的将燃料和氧化剂的化学能直接转化为电能的化学电池。氢气、烃、肼、甲醇等液体或气体,均可以作燃料电池的燃料。请回答下列问题:
(I)以甲烷和氧气为原料,氢氧化钠溶液为电解质溶液构成电池。写出其正极电极反应式 。
(II)以上述电池为电源,石墨为电极电解1L 0. 1mol/L的氯化钾溶液。回答下列问题:
(1)写出电解总反应的离子方程式 。
(2)室温时,电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸,加入醋酸的体积与溶液的pH的关系如图所示(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①计算消耗标准状况下甲烷 mL。
②若图中的B点pH=7,则酸碱恰好完全反应的点在 区间(填“AB”、“BC”或“CD”)。
③AB区间溶液中各离子浓度大小关系中可能正确的是 。
A. c(K+)>c(OH-)>c (CH3COO-) >c(H+)
B. c(K+)>c(CH3COO-)>c(OH-) >c(H+)
C. c(K+)>c(CH3COO-)=c(OH-) >c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com