
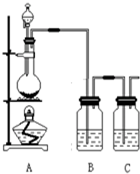
 为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题:
为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题:分析 可利用Cl2+2KI=2KCl+I2验证氯元素的非金属性比碘元素的非金属性强,实验时,A发生MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2+2H2O,生成的氯气经除杂后,与碘化钾发生氧化还原反应,最后用氢氧化钠溶液进行尾气的吸收,以此解答该题.
解答 解:(1)装置B中盛放的试剂淀粉碘化钾,发生Cl2+2KI=2KCl+I2,C中盛装的试剂是吸收多余的氯气,用氢氧化钠溶液,故答案为:A;B;
(2)氯气与碘化钾发生置换反应,生成碘单质与淀粉变蓝,装置B中实验现象是淀粉碘化钾溶液变蓝,反应的化学反应方程式Cl2+2KI=2KCl+I2,
故答案为:淀粉碘化钾溶液变蓝;Cl2+2KI=2KCl+I2;
(3)C装置的作用是吸收多余的氯气,故答案为:除去多余的氯气;
(4)能证明氯元素比碘元素非金属性强的依据:氯原子比碘原子更容易获得电子形成离子,得电子能力越强非金属性越强;通过最高价含氧酸的酸性可以比较非金属性;I-比Cl-还原性强,根据阴离子的还原性越弱非金属性越强来判断;氢化物越稳定,非金属性越强,所以通过高氯酸酸性强于高碘酸,氯的非金属性强于碘元素的非金属性,
故答案为:通过高氯酸酸性强于高碘酸,氯的非金属性强于碘元素的非金属性.
点评 本题考查物质的性质比较,为高频考点,注意从实验装置着眼,从比较Cl和I的非金属性强弱着手,从整体的角度把握题目需要解答的问题,要通过本题建立解答本类题的正确思维过程.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠在水中的电离:NaHCO3═Na++H++CO32- | |
| B. | 钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 氯气和水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 铝和烧碱溶液的反应:Al+2OH-═AlO-2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
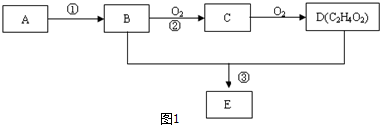
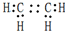 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.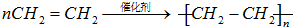 ,反应类型是加聚反应.
,反应类型是加聚反应.
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
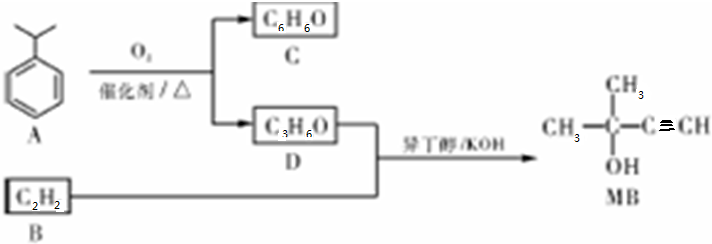
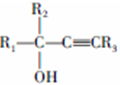
 ,D的官能团名称为羰基.
,D的官能团名称为羰基.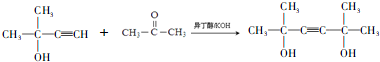 .
. .
.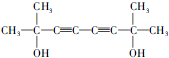 ,医药中间体,材料中间体)的合成路线
,医药中间体,材料中间体)的合成路线 或
或 .
.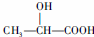 $→_{△}^{浓硫酸}$CH2=CH-COOH$→_{浓硫酸/△}^{CH_{3}OH}$CH-COOH3.
$→_{△}^{浓硫酸}$CH2=CH-COOH$→_{浓硫酸/△}^{CH_{3}OH}$CH-COOH3.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
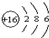 ;该元素最高正化合价与最低负化合价分别是+6和-2.
;该元素最高正化合价与最低负化合价分别是+6和-2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
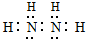 .
. HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
HCO3-+OH-. 0.2mol/L该溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2和HBrO3均是氧化产物 | |
| B. | BrF3既是氧化剂,又是还原剂 | |
| C. | BrF3的氧化性强于O2 | |
| D. | 反应中,若生成1molBr2,则反应转移6NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com