C
分析:A、依据化合价升降守恒,原子守恒、电荷守恒分析判断;
B、醋酸是弱电解质,不能拆成离子;
C、向Ba(OH)
2溶液中逐滴加入明矾溶液,至生成沉淀的物质的量最大时应是铝离子恰好沉淀;
D、过量铁粉产物中生成亚铁离子.
解答:A、KIO
3氧化酸性溶液中的KI产物中不能生成氢氧根离子,反应的离子方程式为:5I
-+IO
-3+6H
+═3I
2+3H
2O;故A错误;
B、醋酸是弱酸离子方程式中写分子式,不能拆成离子,故B错误;
C、向Ba(OH)
2溶液中逐滴加入明矾溶液,至生成沉淀的物质的量最大时应是铝离子恰好沉淀,离子方程式为:2Al
3++3SO
42-+3Ba
2++6OH
-═3BaSO
4↓+2Al(OH)
3↓故C正确;
D、浓硝酸中加入过量铁粉并加热生成亚铁离子:Fe+2NO
3-+4H
+
Fe
2++2NO
2↑+2H
2O;故D错误;
故选C.
点评:本题考查了离子方程式的注意问题和正误判断方法,主要考查氧化还原反应的判断.弱电解质的书写原则,量不同产物不同的定量分析.

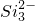 +2H+═H2SiO3↓
+2H+═H2SiO3↓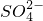 +3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓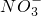 +6H+
+6H+ Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O Fe2++2NO2↑+2H2O;故D错误;
Fe2++2NO2↑+2H2O;故D错误;
