
分析 (1)根据铁元素的化合价变化可知三价铁离子被还原来分析维生素C的作用,并利用还原剂具有还原性来解答;
(2)①根据铁元素和氮元素化合价的变化以及电子守恒知识来回答;
②氧化剂是化合价降低元素所在的反应物,根据原子守恒确定N的氧化物中x和y的值;
(3)亚铁离子可以被高锰酸钾氧化为三价铁离子,根据电子守恒确定化学方程式的系数,据消耗高锰酸钾的量确定亚铁离子的量,结合羟胺的酸性溶液跟足量的硫酸铁反应的电子守恒来定羟胺的氧化产物.
解答 解:(1)服用维生素C,可使食物中的Fe3+转化为Fe2+,该转化过程中三价铁是氧化剂,维生素C是还原剂,根据还原剂的还原性强于还原产物的还原性,即维生素C的还原性强于亚铁离子,
故答案为:还原;氧化;强;
(2)11.4g即0.075molFeSO4和加入的50mL 0.5mol/L KNO3溶液反应,其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出,则铁元素化和价从+2价升高为+3价,根据电子守恒,则0.075mol(3-2)=0.025mol(5-x),解得x=2,所以x=y=1,硝酸的还原产物是一氧化氮,所有的铁元素化合价升高了2价,所有的氮元素化合价降低了3价,所以硫酸亚铁前边系数是6,硫酸铁前边系数是3,硝酸钾前边系数是2,一氧化氮前边系数是2,根据元素守恒,硫酸的系数是4,硫酸钾的系数是1,水的系数是4,电子转移的方向和数目如下: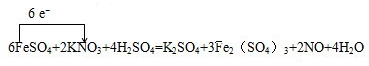 ,
,
故答案为:6;2;4;1;3;2;4;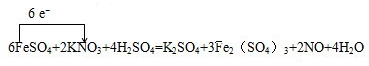 ;
;
②化合价降低的N元素所在的反应物硝酸是氧化剂,对应的还原产物是一氧化氮,
故答案为:KNO3;NO;
(3)亚铁离子可以被高锰酸钾氧化为三价铁离子,Fe2+离子与酸性高锰酸钾反应的离子方程式为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O,
24.5mL 0.020mol/L的KMnO4酸性溶液消耗亚铁离子的物质的量为:5×0.0245L×0.020mol/L=0.00245mol,
25.00mL 0.049mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子的反应中,铁元素化合价降低,氮元素化合价升高,根据电子守恒,
设氮元素化合价变为x价,
0.00245mol(3-2)=0.02500L×0.049mol/L(x+1),
解得x=1,
所以羟胺的氧化产物是N2O,
故答案为:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O;N2O
点评 本题考查氧化还原反应,题目涉及中氧化剂、还原剂及氧化性、还原性,电子转移的表示方法、方程式的书写和配平等,明确元素的化合价变化来分析是解答本题的关键,题目难度中等,侧重于考查学生的分析能力和计算能力.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80gCuO和Cu2S的混合物含有的Cu原子数一定是NA | |
| B. | 标准状况下,5.6L O2作为氧化剂时转移的电子数一定为NA | |
| C. | 常温常压下,14g C2H4和C3H6混合气体中含有的原子数为3NA | |
| D. | 25℃,1LpH=13的NaOH溶液中含有OH-的数目为 0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等物质的量浓度的强酸中所含的H+数目一定相等 | |
| B. | 1L二氧化碳气体一定比1L氧气的质量大 | |
| C. | 同温同压下,相同体积的物质,它们的物质的量必定相等 | |
| D. | 任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
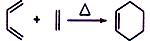
 ,化学名称是2-甲基-1,3-丁二烯;
,化学名称是2-甲基-1,3-丁二烯;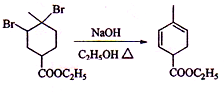
 :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的少量O2:通过灼热的Cu粉,收集气体 | |
| B. | 除去Cl2中的少量HCl:通入饱和NaCl溶液,干燥后收集气体 | |
| C. | 除去Fe2O3固体中少量Al2O3:加入足量NaOH溶液,过滤、洗涤、干燥 | |
| D. | 除去Na2CO3溶液中的NaHCO3可采用加热的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com