
| A. | 整个过程共发生2个氧化还原反应 | |
| B. | 在该溶液中滴少量品红,品红褪色 | |
| C. | 所有离子的浓度都发生了变化 | |
| D. | 反应过程中氯气既作氧化剂又作还原剂 |
分析 某溶液中含有SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体,氯气过量时溶液中含具有漂白性的HClO,以此解答该题.
解答 解:A.发生了氯气氧化SO32-、Br-2个氧化还原反应,另外还存在氯气和水的反应,故A错误;
B.氯气过量,溶液中含HCl哦,具有漂白性,在该溶液中滴少量品红,品红褪色,故B正确;
C.SO32-可以被氯气氧化为硫酸根离子;SiO32-和氯水中的盐酸反应生成硅酸沉淀;Br-被氯气氧化为溴单质;CO32-和氯水中的盐酸反应生成二氧化碳气体,所有阴离子的浓度都发生了变化,但Na+浓度不变,故C错误;
D.与SO32-、Br-反应中氯气得到电子,氯气作氧化剂,而只有氯气与水反应中Cl元素的化合价既升高又降低,氯气既作氧化剂又作还原剂,故D错误;
故选B.
点评 本题考查离子的共存及氯气的性质,为高频考点,把握物质的性质、发生的反应为解答本题的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的碱性减弱,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗0.1molO2则阳极理论上生成0.2molCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
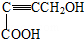 是重要的化工原料,其合成过程如图:
是重要的化工原料,其合成过程如图: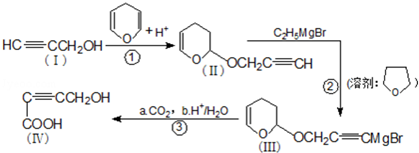
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液,有白色沉淀生成,证明含有Cl- | |
| B. | 加入BaCl2溶液,产生白色沉淀,证明有SO42- | |
| C. | 加入盐酸,放出能使澄清石灰水变浑浊的气体,证明有CO32- | |
| D. | 加浓NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝色的气体,证明有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
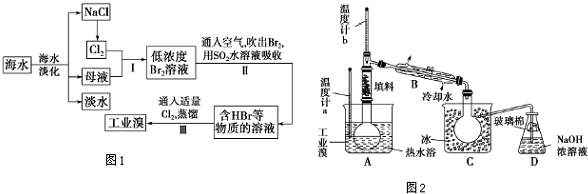
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++NO3-═Fe3++NO2↑+H2O | |
| B. | 向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O═Mg(OH)2↓+2Na+ | |
| C. | 向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 向漂白粉溶液中通入SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
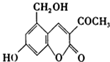 ,它配以辅料丙二醇溶成针剂用于临1,3,5
,它配以辅料丙二醇溶成针剂用于临1,3,5查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(B2)=0.8mol/(L•s) | B. | V(A2)=0.4mol/(L•s) | C. | V(C)=0.6mol/(L•s) | D. | V(B2)=1.8mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com