
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水![]() 混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为
混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为![]() 。下列有关说法正确的是
。下列有关说法正确的是

A. 正极反应式:![]()
B. 放电过程中,![]() 向负极移动
向负极移动
C. 常温时,在正负极间接上电流表或检流计,指针发生偏转
D. 每转移0.1mol电子,理论上生成10.35gPb
【答案】D
【解析】
由原电池总反应可以知道Ca为原电池的负极,发生氧化反应,电极方程式为Ca+2Cl--2e-=CaCl2,硫酸铅为原电池的正极,发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,原电池工作时,阳离子向正极移动,阴离子向负极移动,结合电解方程式计算。
A.正极发生还原反应,电极方程式为PbSO4+2e-+2Li+=Li2SO4+Pb,故A错误;
B.放电过程中阳离子向正极移动,Li+向正极移动,故B错误;
C.常温下,电解质不是熔融态,离子不能移动,不能产生电流,因此连接电流表或检流计,指针不偏转,故C错误;
D.根据电极方程式PbSO4+2e-+2Li+=Li2SO4+Pb,可以知道每转移0.1mol电子,理论上生成0.05molPb,质量为10.35g,所以D选项是正确的。
所以D选项是正确的。


科目:高中化学 来源: 题型:
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:
![]()
(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式________________、__________________。
(2)基态铜原子的核外电子排布式为____________,硫、氧元素相比,第一电离能较大的是______。
(3)反应①和②生成的气体分子的中心原子的杂化类型是______,分子的空间构型是______。
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键________________。
(5)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密度为__________g·cm-3(用NA表示阿伏加德罗常数的数值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
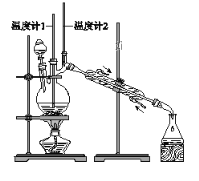
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]()
![]()
![]()
Ⅰ.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
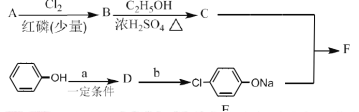
(1)A为一元羧酸,8.8gA与足量![]() 溶液反应生成2.24L
溶液反应生成2.24L![]() (标准状况),A的分子式为__________。
(标准状况),A的分子式为__________。
(2)写出符合A分子式的所有甲酸酯的结构简式:__________。
(3)B是氯代羧酸,其核磁共振谱有两个峰,写出![]() 的反应方程式:__________。
的反应方程式:__________。
(4)![]() 的反应类型为__________。
的反应类型为__________。
(5)写出A和F的结构简式:A.__________;F.__________。
(6)D的苯环上有两种氢,它所含官能团的名称为__________;写出a、b所代表的试剂:a.__________;b.__________。
Ⅱ.(7)有机物H的分子式为![]() ,可发生银镜反应,且具有酸性H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)______________________.
,可发生银镜反应,且具有酸性H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g),在673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
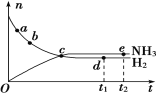
A. 点a的正反应速率比点b的小B. 点c处反应达到平衡
C. 点d(t1时刻)和点e(t2时刻)处n(N2)不一样D. 点e处反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH![]() ClO+Cl+H2O是放热反应。
ClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为____________________________________;实验中控制温度除用冰水浴外,还需采取的措施是____________________________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如题19图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________;使用冷凝管的目的是_________________________________。

(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、![]() 、
、![]() 随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。
随pH的分布如题19图2所示,Na2SO3的溶解度曲线如题19图3所示)。

①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com