
(12分)甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。

请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为___________________________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________________。
(4)写出B+C―→D的化学方程式:__________________________________;
写出E+G―→F的离子方程式:____________________________________。
(12分)
(1)O2 SO3 (2) 
(3)增强溶液的导电能力
(4)Na2O2+SO2===Na2SO4 OH-+HCO3-===CO32-+H2O
【解析】
试题分析:甲、乙、丙为常见单质,A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,均含有Na元素,B能与二氧化碳、水反应生成单质丙,则B为Na2O2,丙为O2,A为Na,E为NaOH,F为Na2CO3,G的焰色反应为黄色,与氢氧化钠反应得到碳酸钠,判断G为NaHCO3;C能使品红溶液褪色,由单质乙与氧气反应得到,则乙为S,A为Na2S,C为SO2,H为SO3,D为Na2SO4。
(1)由上述分析可知,丙为O2,H为SO3。
(2)A为Na2S,电子式为:  。
。
(3)电解NaOH的水溶液时,实质是电解水,NaOH起到的作用是:增强溶液导电能力。
(4)B+C→D是过氧化钠与二氧化硫反应生成硫酸钠,反应化学方程式为:Na2O2+SO2=Na2SO4;
B和G是氢氧化钠和碳酸氢钠溶液的反应,反应的离子方程式为:HCO3-+OH-=CO32-+H2O。
考点:本题考查物质的推断、电子式的书写、电解、方程式的书写。


科目:高中化学 来源:2015届贵州省贵阳市高三年级8月摸底考试化学试卷(解析版) 题型:选择题
以“改革驱动,走向生态文明新世代”为主题的生态文明贵阳国际论坛2014年7月在贵阳召开,本次年会确定以植树造林增加碳汇的方式,实现“碳中和”目标。下列行为与此次目标不相符的是
A.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,以提高空气质量
B.开发时能、风能、太阳能、地热能、核能等新能源,减少使用煤、石油等化石燃料
C.大力开采煤、石油和天然气,以满足经济发展的需要
D.大力发展新能源汽车,如混合动力汽车、电动汽车等,以减少碳、氮氧化物的排放
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A、碳酸钡与足量盐酸反应:2H++BaCO3=Ba2++H2O+CO2↑
B、氯气通入蒸馏水中:Cl2+H2O=Cl﹣+ClO﹣+2H+
C、氢氧化钡溶液与稀硫酸混合:Ba2++SO42﹣+H++OH﹣=BaSO4↓+H2O
D、过量CO2通入澄清石灰水中:CO2+Ca(OH)2 =CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:实验题
(15分)I2O5是白色固体,遇水生成碘酸(HIO3)。I2O5可用于检验并定量测定空气中的CO,在常温下发生的反应为 5CO+I2O5=5CO2+I2 (空气中其余气体不与I2O5反应)。
实验一:制取I2O5
将碘酸加热至90~110 ?C使其部分脱水,再升温至220~240 ℃并恒温4 h,使反应完全。接着慢慢冷却至室温,密封保存,即得五氧化二碘。
(1)写出碘酸制I2O5的化学方程式: 。
(2)在制得的I2O5固体中含有少量I2杂质,提纯的方法是 (填标号);
A.过滤 B.蒸发结晶 C.蒸馏 D.升华
用提纯方法用到的玻璃仪器为 (填标号)。
A.圆底烧瓶 B.烧杯 C.普通漏斗 D.酒精灯 E.玻璃棒
实验二:检验空气中CO
利用下图装置检验空气中是否存在CO。
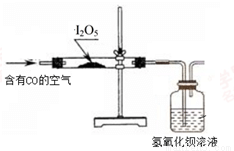
(3)能说明空气中含有CO的现象是 。
(4)倘若要从广口瓶中出现浑浊来判断空气中含有CO,请写出改进的实验方案: 。
实验三:测定空气中CO的含量
(5)将I2O5与CO反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗v mL c mol·L-1 Na2S2O3溶液。则该空气样品中CO的体积分数是 。
(6)该实验测定出来的结果不可信,最大可能的原因是: 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:选择题
如图所示,X、Y、Z为短周期元素,且X、Z的核外电子数之和等于Y的核外电子数,下列说法不正确的是
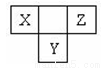
A.三种元素中,Z元素原子半径最小
B.X、Y 两种元素的气态氢化物能相互反应
C.Z位于元素周期表中第2周期、第ⅥA族
D.Y元素的气态氢化物与X 的最高价氧化物对应的水化物能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
现有如下几个离子方程式①CaCO3+2H+===Ca2++H2O+CO2↑
② 
③
④  ,
,
由此得出的如下结论中不正确的是
A. 与H+、Ca2+不能大量共存
与H+、Ca2+不能大量共存
B.H2CO3的酸性比HClO强,比H2SO3弱
C.H2SO3是一种强酸
D.H2CO3、HClO都属于弱酸
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
关于pH相同的醋酸和盐酸,下列叙述不正确的是
A.取等体积的两种酸分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n
B.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸
C.取等体积的两种酸分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸消耗的多
D.两种酸中c(CH3COO-)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:填空题
(15分)电石是重要的工业原料,电石渣[主要成分Ca(OH)2]的综合利用体现了绿色化学思想。
(1)用电石为原料可生产聚氯乙烯。聚氯乙烯的结构简式为____________。
(2)电石渣可用于除去垃圾焚烧炉烟道气中的SO2生成CaSO4,反应中的氧化剂是____________(填名称)。
(3)电石渣可用于生产纯碱。涉及的部分化学反应为:
(i)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(ii)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
此生产过程中,可循环利用的物质有____________(填化学式)。
(4)用电石渣处理酸性含铬(Cr2O72—)电镀废水的流程如下:

①步骤(i)发生反应的化学方程式为__________________
②步骤(ii)发生反应的离子方程式为__________________
③步骤(iii)调节溶液pH为8,则残留Cr3+的浓度为___(Ksp[Cr(OH)3]=6.3×10—31)。
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:填空题
(16分)X、Y、Z、W四种常见元素,且均为短周期元素。
已知:①X的最高价氧化物对应的水化物为无机酸中最强酸
②Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料
③Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料
④W被称为军事金属,可在CO2中燃烧。
(1)X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(2)Z的氧化物在通讯领域用来作 ,工业上制Z单质的化学反应方程式为 。
(3)在50mL ,lmol·L-1的YX3溶液中逐滴加入0.5mol·L-1的NaOH溶液,得到1.56g沉淀,则加入NaOH溶液的体积最多为 mL。
(4)Y、W合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某Y、W合金(设不含其他元素)中W的质量分数,设计下列三种不同的实验方案进行探究。填写下列空白:
[探究一]
实验方案:Y、W合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称取一定质量的Y、W合金粉末样品,加入过量的Na0H溶液,充分反应。实验中发生反应的化学方程式是 。
②过滤、洗涤、干燥、称量剩余固体。若未洗涤固体,将导致测得的W的质量分数
(填“偏高”或“偏低”)。
[探究二]
实验方案:称量xg Y、W合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。

问题讨论:
③欲计算W的质量分数。该实验中还需测定的数据是 。
④若用空气代替O2进行实验,对测定结果是否有影响? (填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com