
| A. | ①③⑤ | B. | ②④ | C. | ①②④ | D. | ②④⑥ |
分析 ①加入铝粉只有氢气产生的溶液,为非氧化性酸或强碱溶液;
②pH=11的溶液,显碱性;
③水电离的H+浓度为10-12mol•L-1的溶液,为酸或碱溶液;
④加入Mg能放出H2的溶液,为非氧化性酸溶液;
⑤使甲基橙变黄的溶液,显酸性或碱性;
⑥Fe3+在pH为4.4左右沉淀完全.
解答 解:①加入铝粉只有氢气产生的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Mg2+,酸溶液中Al、NO3-发生氧化还原反应不生成氢气,故不选;
②pH=11的溶液,显碱性,该组离子之间不反应,可大量共存,故选;
③水电离的H+浓度为10-12mol•L-1的溶液,为酸或碱溶液,酸溶液中不能大量存在CO32-、SO32-,故不选;
④加入Mg能放出H2的溶液,为非氧化性酸溶液,酸溶液中该组离子之间不反应,可大量共存,故选;
⑤使甲基橙变黄的溶液,显酸性或碱性,酸溶液中Fe2+、MnO4-或NO3-发生氧化还原反应,碱溶液中不能大量存在Fe2+,故不选;
⑥Fe3+在pH为4.4左右沉淀完全,则中性溶液中不能大量存在,故不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、复分解反应判断,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 如图是同学们经常使用的某品牌修正液包装标签.小明仔细阅读后,结合自己的生活经验和所学知识得出了修正液的某些性质,小明的推测中不合理的是( )
如图是同学们经常使用的某品牌修正液包装标签.小明仔细阅读后,结合自己的生活经验和所学知识得出了修正液的某些性质,小明的推测中不合理的是( )| A. | 修正液是一种胶体,均一、稳定 | B. | 修正液中含有有毒的化学物质 | ||
| C. | 修正液的成分对纸张不具腐蚀性 | D. | 修正液的溶剂易挥发、易燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
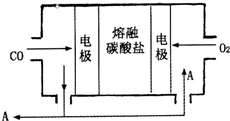 用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.
用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如图:负极电极反应式为2CO-4e-+2CO32-=4CO2,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把SiO2加入到NaOH溶液中:SiO2+2OH-═SiO32-+H2O | |
| B. | 向NaHCO3溶液中滴入NaOH溶液:HCO3-+OH-═CO2↑+H2O | |
| C. | 向Al(OH)3中滴入H2SO4溶液:Al(OH)3+3H+═Al3++3H2O | |
| D. | 向Na2CO3溶液中滴入AgNO3溶液:2Ag++CO32-═Ag2CO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
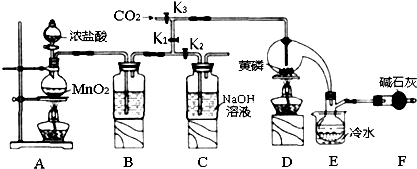
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com