
【题目】一种测定O2含量的气体传感器如图所示。传感器工作时, 仅Ag+能在α-AgI晶体里迁移,O2透过聚四氟乙烯进入传感器、AgI的物质的量增加。下列有关说法不正确的是
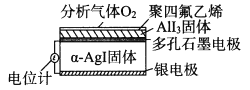
A. 正极反应为I2+2Ag++2e-=2AgI B. 负极反应为Ag+I――e-=AgI
C. 电位计读数越大O2含量越高 D. 部分AlI3固体变为Al2O3固体
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为_______。
②图B中T=500℃,则温度为450℃时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
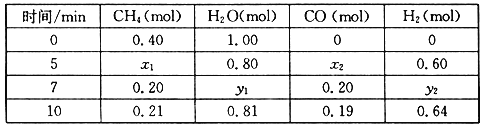
①分析表中数据,判断5 min时反应是否处于平衡状态?_____(填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/molL-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105Pa增加到5×105Pa时,平衡______移动(填“正向、逆向或不”)。
②当压强为1×106Pa时,此反应的平衡常数表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是
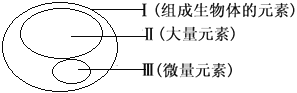
A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. (1)下列条件的改变能增大活化分子百分数的是_____________。
A.增大压强 B.增大反应物的浓度
C.升高温度 D.使用催化剂
(2)破坏(或形成)1 mol化学键所吸收(或放出)的能量称为键能。已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P-P 198、Cl-Cl 243、P-Cl 331。

则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热△H=__________kJ·mol-1。
Ⅱ.2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。

已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99 kJ·mol-1。请回答下列问题:
(1)图中C表示___________,E表示______________;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是____________ ;
(2)图中△H=_________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,向20 mL NaOH溶液中逐滴加入0.1 mol·L-1的醋酸溶液,滴定曲线如下图所示。下列判断中,正确的是

A. 在M点,二者恰好完全反应
B. 滴定前,酸中c(H+)等于碱中c(OH-)
C. NaOH溶液的物质的量浓度为0.1 mol·L-1
D. 在N点,c(CH3COOH)>c(CH3COO-)>c(Na+)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com