
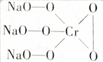
 ,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.
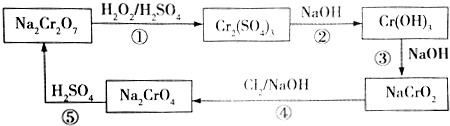
,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.分析 Cr2O72-具有强氧化性,在酸性溶液中能将H2O2氧化为O2,的硫酸铬,溶液中加入氢氧化钠生成氢氧化铬,继续加入氢氧化钠溶液,氢氧化铬溶解得到NaCrO2,类似于氢氧化铝的性质,在NaCrO2溶液中通入氯气发生氧化还原反应生成Na2CrO4,加入硫酸转化为Na2Cr2O7,
(1)根据化合物化合价代数和为0结合阴离子结构为 解答;
解答;
(2)反应①重铬酸钠在酸性溶液中和过氧化氢发生氧化还原反应生成硫酸铬,过氧化氢被氧化生成氧气,结合氧化还原反应电子守恒和化学方程式定量关系就是得到一件和还原剂物质的量之比;
(3)根据反应②③,可知Cr(OH)3可以和强碱反应,生成NaCrO2,说明Cr(OH)3显示弱酸性,存在一步电离,从反应③可以看出,Cr(OH)3可以与NaOH溶液反应生成NaCrO2,所以除去Fe3+中的Cr3+时,可以加入过量的NaOH溶液,使Cr3+转化为CrO,Fe3+转化为Fe(OH)3沉淀,在过滤得到的Fe(OH)3中加入盐酸即得到FeCl3溶液;
(4)步骤⑤中,Cr元素的化合价从+3升高到了+6价,所以需要加入氧化剂Cl2,在碱性溶液中发生氧化还原反应;
(5)根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
解答 解:(1)因为化合物化合价代数和为0,又化学式Na3CrO8中阴离子结构可表示为 ,则氧为-1价,钠为+1价,所以铬为+5,化合物中含有化学键类型为离子键、共价键,
,则氧为-1价,钠为+1价,所以铬为+5,化合物中含有化学键类型为离子键、共价键,
故答案为:+5;离子键、共价键;
(2)H2O2既具有氧化性,又具有还原性;Cr2O72-具有强氧化性,能将H2O2氧化为O2,反应中+6价Cr元素被还原为+3价,离子反应为Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O,氧化剂和还原剂物质的量之比为1:3,
故答案为:1:3;
(3)根据反应②③,可知Cr(OH)3可以和强碱反应,生成NaCrO2,说明Cr(OH)3显示弱酸性,存在一步电离,电离方程式为:Cr(OH)3?H2O+CrO2-+H+,从反应③可以看出,Cr(OH)3可以与NaOH溶液反应生成NaCrO2,所以除去Fe3+中的Cr3+时,可以加入过量的NaOH溶液,使Cr3+转化为CrO,Fe3+转化为Fe(OH)3沉淀,在过滤得到的Fe(OH)3中加入盐酸即得到FeCl3溶液,
故答案为:Cr(OH)3?H2O+CrO2-+H+;CrO2-;Fe(OH)3;
(4)步骤⑤中,Cr元素的化合价从+3升高到了+6价,所以需要加入氧化剂Cl2,在碱性溶液中发生氧化还原反应,铬元素化合价+3价变化为+6价,氯元素化合价0价变化为-1价,结合电子守恒、电荷守恒和原子守恒配平书写离子方程式为:2CrO2-+3Cl2+8OH-=2CrO42-+6Cl-+4H2O,
故答案为:2CrO2-+3Cl2+8OH-=2CrO42-+6Cl-+4H2O;
(5)处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成 $\frac{2}{2-x}$molFeⅡ[FeⅢx•CrⅢ2-x]O4,根据铁原子守恒得amol=$\frac{2(1+x)}{2-x}$mol①,该反应中得失电子数相等,1mol×2×3=$\frac{2}{2-x}$mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10,
故答案为:D.
点评 本题考查较为综合,涉及实验操作、离子方程式的书写、电子守恒的计算等,题目难度中等,解答本题,要充分把握题给信息,牢固掌握物质的性质.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | K2CO3?2K++CO32- | D. | CH3COONH4=NH4++CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始物质的量/mol | 2 | 4 | 0 |
| 4 min末物质的量/ihol | 1.6 | 2.8 | a |
| 平衡物质的量/mol | 1 | b | 2 |
| A. | a=0.8 | |
| B. | t℃该反应的平衡常数为4 | |
| C. | 前4min内,用Z的变化量表示的平均反应速率V(Z)=0.1mol•L-1•min-1 | |
| D. | 升高平衡后的体系温度,V逆:增大,V正增大,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )与P(
)与P( ),下列有关它们的说法中正确的是( )
),下列有关它们的说法中正确的是( )| A. | 二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3:1 | |
| B. | 二者在NaOH醇溶液中均可发生消去反应 | |
| C. | 一定条件下,二者在NaOH溶液中均可发生取代反应 | |
| D. | Q的一氯代物只有1种,P的一溴代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为283 kJ | |
| B. |  如图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,生成53gNa2CO3(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O.
,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式Cu+2H++H2O2=Cu2++2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中碳、氢、氧原子个数比为1:2:3 | |
| B. | 该有机物中肯定不含氧 | |
| C. | 该有机物分子中碳、氢原子个数比为1:2 | |
| D. | 该有机物中肯定含有氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑥ | C. | ①④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )| A. | 水是弱电解质,某温度下,纯水的pH=6,则说明显酸性 | |
| B. | 可燃冰是可以燃烧的水 | |
| C. | 在相同温度下,水的电离常数与水的离子积常数相等 | |
| D. | 在水中加入Na或NaH,都将促进水的电离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com