
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子。下列叙述中正确的是( )

A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处移动
C. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
D. 通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2O
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新化学键形成的过程。化学键的键能是两个原子间形成1 mol化学键时释放的能量或断开1 mol化学键所吸收的能量。
现提供以下化学键的键能:(kJ·mol1)P—P:198 P—O:360 O==O:498 P==O:585。
则P4(白磷)+5O2![]() P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图
P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图 ,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成药物X、Y和高聚物Z,可以用烃A为主要原料,采用以下路线:

已知:I.反应①、反应②均为加成反应。
II.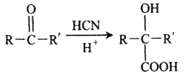
请回答下列问题:
(1)A的结构简式为_____________。
(2)Z中的官能团名称为____________,反应③的条件为___________.
(3)关于药物Y(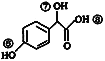 )的说法正确的是____________。
)的说法正确的是____________。
A.1mol药物Y与足量的钠反应可以生成33.6 L氢气
B.药物Y的分子式为C8H8O4,能使酸性高锰酸钾溶液褪色
C.药物Y中⑥、⑦、⑧三处-OH的活泼性由强到弱的顺序是⑧>⑥>⑦
D.1mol药物Y与H2、浓溴水中的Br2反应,最多消耗分别为4 mol和2 mol
(4)写出反应E→F的化学方程式______________________________________。F→X的化学方程式______________________________________________。
(5)写出符合下列条件的E的一种同分异构体的结构简式_______________。
①遇FeCl3溶液可以发生显色反应,且是苯的二元取代物;
②能发生银镜反应和水解反应;
③核磁共振氢谱有6个峰。
(6)参考上述流程以CH3CHO和CH3OH为起始原料,其它无机试剂任选设计合成Z的线路___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为![]() ,关于该有机物,下列叙述正确的是( )
,关于该有机物,下列叙述正确的是( )
A. 所有碳原子可能处于同一平面
B. 属于芳香族化合物的同分异构体有三种
C. 能发生取代反应、氧化反应和加成反应
D. 能使溴水、酸性KMnO4溶液褪色且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动潜艇的液氨![]() 液氧燃料电池原理示意如图,下列有关该电池说法正确的是
液氧燃料电池原理示意如图,下列有关该电池说法正确的是

A.该电池工作时,每消耗![]()
![]() 转移3mol电子
转移3mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,![]() 向电极B移动
向电极B移动
D.电极B上发生的电极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入6mol·L-1的H2SO4溶液中,乙同学将两电极放入6mol·L-1的NaOH溶液中,装置如图所示。

(1)写出图1中正极的电极反应式:_______________ 。
(2)图2中负极为_______________,总反应的离子方程式为____________。
(3)由该实验得出的下列结论中,正确的有 _______________(填序号)。
a.利用原电池反应判断金属活动性强弱时应注意原电池中的电解质溶液
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序表已过时,没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/c(CH3COOH)·c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 向AgCl、AgBr的饱和溶液中加入少量硝酸银,溶液中c(Cl-)/c(Br-)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图______________。
(2)写出Y元素最高价氧化物分别与HCl、NaOH溶液反应的离子方程式____________________、______________________。
(3)写出Z的电子排布式_____、铬原子的简化的电子排布式______。
(4)元素T与氯元素相比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___(填字母代号)。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是___(填元素符号),理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:3A(g)![]() 3B(?)+C(?)(正反应是吸热反应),随着温度的升高,气体平均相对分子质量有减小趋势,则下列判断正确的是
3B(?)+C(?)(正反应是吸热反应),随着温度的升高,气体平均相对分子质量有减小趋势,则下列判断正确的是
A. B和C可能都是固体 B. B和C一定都是气体
C. 若C为固体,则B一定是气体 D. B和C不可能都是气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com