
| A. | 金属腐蚀就是金属原子失去电子被还原的过程 | |
| B. | 钢铁吸氧腐蚀时,负极的电极反应式为:2H2O+O2+4e-═4OH- | |
| C. | 在铁上镀锌时,应让锌作阴极,铁作阳极 | |
| D. | 铝制品不需要特殊的防腐措施原因是铝易于被氧气氧化形成致密的氧化物保护膜 |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅的化学性质不活泼,能与强碱反应不与任何酸反应 | |
| B. | 生物炼铜就是利用植物对铜离子的吸收达到富集铜的目的 | |
| C. | 过量二氧化硫通入石蕊溶液中能使石蕊溶液先变红色后褪色 | |
| D. | 工业上利用氢气在氯气中燃烧生成氯化氢,再将氯化氢溶于水制得盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卢瑟福首先提出了原子学说 | |
| B. | 地球上大量的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| C. | 利用同位素治疗肿瘤证明任何同位素对人都不会造成危害 | |
| D. | 利用焰色反应可以鉴别所有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ | B. | Mg2+ | C. | CO32- | D. | Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
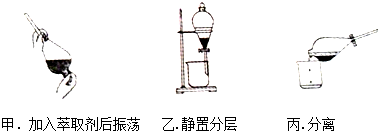 某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图:
某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com