
”¾ĢāÄæ”æBaCl2æÉÓĆÓŚµē×Ó”¢ŅĒ±ķµČ¹¤Ņµ”£ŅŌ¶¾ÖŲŹÆ(Ö÷ŅŖ³É·ÖĪŖBaCO3£¬ŗ¬ÉŁĮæµÄCaCO3”¢MgSO4”¢Fe2O3”¢SiO2µČŌÓÖŹ)ĪŖŌĮĻ£¬Ä£Äā¹¤ŅµÖĘČ”BaCl2”¤2H2OµÄĮ÷³ĢČēĻĀĶ¼ĖłŹ¾:

ŅŃÖŖ:Ksp(BaC2O4)£½1.6”Į10-7£¬Ksp(CaC2O4)£½2.3”Į10-9
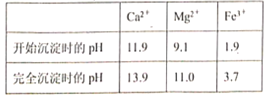
(1)ŃĪĖį½žČ”Ź±ŠčŅŖŹŹµ±¼ÓČȵÄŌŅņŹĒ_________”£
(2)ÓĆ37£„µÄŃĪĖįÅäÖĘ15£„µÄŃĪĖįŠčÓƵ½µÄŅĒĘ÷ÓŠ________(Ģī×ÖÄø)
A.ĮæĶ² B.ÉÕ± C.ČŻĮæĘæ D.²£Į§°ō
(3)ĀĖŌüIµÄ³É·ÖĪŖ__________£»
(4)Mg(OH)2µÄČܶȻż³£ŹżKsp£½_______£¬¼ÓČėH2C2O4Ź±·¢ÉśµÄĄė×Ó·“Ó¦ĪŖ_______£¬¼ÓČėH2C2O4Ó¦±ÜĆā¹żĮ棬ĘäŌŅņŹĒ_________”£
(5)ÄøŅŗÖŠ³żĮĖŗ¬ÓŠBa2+”¢Cl”ŖĶā£¬»¹ŗ¬ÓŠ“óĮæµÄ_________(ĢīĄė×Ó·ūŗÅ)£»
(6)ĀĖŌüIII(²»ŗ¬½į¾§Ė®)ŹĒ½įŹÆµÄÖ÷ŅŖ³É·ÖĀĖŌü¢ó¾¹żĻ“µÓøÉŌļŗóŌŚæÕĘųÖŠ½ųŠŠČČÖŲ·ÖĪö£¬Č”128.0gøĆ“æ¾»Īļ£¬ŌŚ200”«470”ę×ĘÉÕ£¬×īŗóµĆµ½100.0g²śĪļ£¬200”«470”ꏱ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___________”£
”¾“š°ø”æ¼Óæģ·“Ó¦ĖŁ¶Č£¬Ģįøß½žČ”ĀŹ ABD SiO2”¢BaSO4 1.0”Į10-11 Ca2++H2C2O4 = CaC2O4 ”ż+ 2H+ ·ĄÖ¹Éś³ÉBaC2O4 Na£« CaC2O4+O2 ![]() 2CaCO3+2CO2
2CaCO3+2CO2
”¾½āĪö”æ
ÓĆŃĪĖį½žČ”¶¾ÖŲŹÆ(Ö÷ŅŖ³É·ÖĪŖBaCO3£¬ŗ¬ÉŁĮæµÄCaCO3”¢MgSO4”¢Fe2O3”¢SiO2µČŌÓÖŹ)£¬SiO2²»ČÜ£¬½žČ”Ņŗŗ¬ÓŠBa2+”¢Ca2+”¢Mg2+”¢Fe3+£¬²æ·ÖBa2+ÓėSO42-Éś³ÉBaSO4³Įµķ£¬ĀĖŌüIµÄ³É·ÖŹĒSiO2”¢BaSO4£¬ÓĆNaOHČÜŅŗµ÷½ŚĀĖŅŗµÄpH=12.5£¬³ĮµķMg2+”¢Fe3+¼°²æ·ÖCa2+£¬¹żĀĖµĆµ½ĀĖŌüIIĪŖMg(OH)2”¢Fe(OH)3”¢Ca(OH)2£¬ĀĖŅŗIIIŗ¬ÓŠBa2+”¢Ca2+£¬¼ÓČė²ŻĖį³ĮµķCa2+£¬ĀĖŌüIIIĪŖCaC2O4£¬½«ĀĖŅŗÕō·¢ÅØĖõ”¢ĄäČ“½į¾§µĆµ½BaCl22H2O£¬¾Ż“Ė·ÖĪö½ā“š”£
(1)ŃĪĖį½žČ”Ź±ŹŹµ±¼ÓČČ£¬æÉŅŌ¼Óæģ·“Ó¦ĖŁ¶Č£¬Ģįøß½žČ”ĀŹ£¬¹Ź“š°øĪŖ£ŗ¼Óæģ·“Ó¦ĖŁ¶Č£¬Ģįøß½žČ”ĀŹ£»
(2)ÓĆ37%µÄŃĪĖįÅäÖĘ15%µÄŃĪĖįŠčÓƵ½µÄŅĒĘ÷ÓŠĮæĶ²”¢ÉÕ±”¢²£Į§°ō£¬¹Ź“š°øĪŖ£ŗABD£»
(3)ŃĪĖį½žČ”¶¾ÖŲŹÆ(Ö÷ŅŖ³É·ÖĪŖBaCO3£¬ŗ¬ÉŁĮæµÄCaCO3”¢MgSO4”¢Fe2O3”¢SiO2µČŌÓÖŹ)£¬SiO2²»ČÜ£¬½žČ”Ņŗŗ¬ÓŠBa2+”¢Ca2+”¢Mg2+”¢Fe3+£¬²æ·ÖBa2+ÓėSO42-Éś³ÉBaSO4³Įµķ£¬ĀĖŌüIµÄ³É·ÖŹĒSiO2”¢BaSO4£¬¹Ź“š°øĪŖ£ŗSiO2”¢BaSO4£»
(4)øł¾Ż±ķøńŹż¾Ż£¬Ć¾Ąė×ÓæŖŹ¼³ĮµķµÄpH=9.1£¬ĶźČ«³ĮµķŹ±µÄpH=11.0£¬µ±c(Mg2+)=1.0”Į10-5 mol/L£¬ŌņKsp[Mg(OH)2]= 1.0”Į10-5”Į(1.0”Į10-3)2=1.0”Į10-11£»¼ÓČėH2C2O4³ĮµķCa2+£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖCa2++H2C2O4 = CaC2O4 ”ż+ 2H+£¬ĪŖ·ĄÖ¹Éś³ÉBaC2O4£¬¼ÓČėH2C2O4Ź±Ó¦±ÜĆā¹żĮ棻¹Ź“š°øĪŖ£ŗ1.0”Į10-11£»Ca2++H2C2O4 = CaC2O4 ”ż+ 2H+£»ĪŖ·ĄÖ¹Éś³ÉBaC2O4£»
(5)BaCl2ÄøŅŗÖŠ³żĮĖŗ¬ÓŠBa2+”¢Cl-Ķā£¬¹ż³ĢÖŠ¼ÓČėĮĖNaOHČÜŅŗ£¬¹Ź»¹ŗ¬ÓŠ“óĮæµÄNa+£¬¹Ź“š°øĪŖ£ŗNa+£»
(6)128g CaC2O4µÄĪļÖŹµÄĮæĪŖ1mol£¬200”«470”ꏱ·¢Éś·“Ó¦µÄÉś³ÉĪļÖŹĮæĪŖ100g£¬ĘäÖŠŗ¬ÓŠ1molCa£¬½įŗĻĢ¼ĖįøʵÄĦ¶ūÖŹĮæĪŖ100g/mol£¬æÉĶĘÖŖĖłµĆ¹ĢĢåĪŖĢ¼ĖįøĘ£¬ŌŁ½įŗĻ¹ĢĢåŹĒŌŚÓŠŃõĢõ¼žĻĀ×ĘÉÕ£¬æÉÖŖ²ŻĖįøĘŗĶŃõĘųŌŚøßĪĀĻĀ¼ÓČČ×ĘÉÕÉś³ÉĢ¼ĖįøĘŗĶ¶žŃõ»ÆĢ¼£¬·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ2CaC2O4+O2![]() 2CaCO3+2CO2£¬¹Ź“š°øĪŖ£ŗ2CaC2O4+O2
2CaCO3+2CO2£¬¹Ź“š°øĪŖ£ŗ2CaC2O4+O2![]() 2CaCO3+2CO2”£
2CaCO3+2CO2ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¢ń£ŗÓĆĖįŠŌKMnO4ŗĶH2C2O4(²ŻĖį)·“Ӧъ¾æÓ°Ļģ·“Ó¦ĖŁĀŹµÄŅņĖŲ£¬Ąė×Ó·½³ĢŹ½ĪŖ2 MnO4-£«5H2C2O4£«6H+ = 2Mn2+£«10CO2”ü£«8H2O”£Ņ»ŹµŃ銔×éÓūĶعż²ā¶Øµ„Ī»Ź±¼äÄŚÉś³ÉCO2µÄĖŁĀŹ£¬Ģ½¾æijÖÖÓ°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄŅņĖŲ£¬Éč¼ĘŹµŃé·½°øČēĻĀ(KMnO4ČÜŅŗŅŃĖį»Æ)£¬ŹµŃé×°ÖĆČēĶ¼¼×ĖłŹ¾£ŗ

ŹµŃéŠņŗÅ | AČÜŅŗ | BČÜŅŗ |
¢Ł | 20 mL 0.1 mol”¤L£1 H2C2O4ČÜŅŗ | 30 mL 0.01 mol”¤L£1 KMnO4ČÜŅŗ |
¢Ś | 20 mL 0.2 mol”¤L£1 H2C2O4ČÜŅŗ | 30 mL 0.01 mol”¤L£1 KMnO4ČÜŅŗ |
(1)øĆŹµŃéĢ½¾æµÄŹĒ_________________________________ŅņĖŲ¶Ō»Æѧ·“Ó¦ĖŁĀŹµÄÓ°Ļģ”£
(2)ČōŹµŃé¢ŁŌŚ2 minÄ©ŹÕ¼ÆĮĖ4.48 mL CO2(±ź×¼×“æöĻĀ)£¬ŌņŌŚ2 minÄ©£¬c(MnO4-)£½________ mol”¤L£1(¼ŁÉč»ģŗĻČÜŅŗµÄĢå»żĪŖ50 mL)”£
(3)Š”×éĶ¬Ń§·¢ĻÖ·“Ó¦ĖŁĀŹ±ä»ÆČēĶ¼ŅŅ£¬ĘäÖŠt1”«t2Ź±¼äÄŚĖŁĀŹ±äæģµÄÖ÷ŅŖŌŅņæÉÄÜŹĒ£ŗ
¢Ł²śĪļMn2£«ŹĒ·“Ó¦µÄ“߻ƼĮ£¬¢Ś_______________________________
¢ņ£ŗµ±ĪĀ¶ČøßÓŚ500 KŹ±£¬æĘѧ¼Ņ³É¹¦ĄūÓƶžŃõ»ÆĢ¼ŗĶĒāĘųŗĻ³ÉĮĖŅŅ“¼£¬ÕāŌŚ½ŚÄܼõÅÅ”¢½µµĶĢ¼ÅÅ·Å·½Ćę¾ßÓŠÖŲ“óŅāŅ唣»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ___________________________________
(2)ŌŚŗćĪĀŗćČŻĆܱÕČŻĘ÷ÖŠ£¬ÅŠ¶ĻÉĻŹö·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŅĄ¾ŻŹĒ________________
a£®ĢåĻµŃ¹Ēæ²»ŌŁøıä b£®H2µÄÅØ¶Č²»ŌŁøıä
c£®ĘųĢåµÄĆÜ¶Č²»Ėꏱ¼äøıä d£®µ„Ī»Ź±¼äÄŚĻūŗÄH2ŗĶCO2µÄĪļÖŹµÄĮæÖ®±ČĪŖ3”Ć1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠÓŠ¹ŲŠšŹö²»ÕżČ·µÄŹĒ(””””)
A. ±ź×¼×“æöĻĀ£¬1LøżĶéĶźČ«Č¼ÉÕĖłÉś³ÉµÄĘųĢ¬²śĪļµÄ·Ö×ÓŹżĪŖ(7/22.4)NA
B. 1 mol¼×»ł(£CH3)Ėłŗ¬µÄµē×Ó×ÜŹżĪŖ9NA
C. 0.5 mol1£¬3£¶”¶žĻ©·Ö×ÓÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼üŹżĪŖNA
D. 1 molĢ¼ÕżĄė×Ó(CH3+)Ėłŗ¬µÄµē×Ó×ÜŹżĪŖ8NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢B”¢C”¢D”¢E”¢FĮłÖÖĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾(·“Ó¦Ģõ¼žŗĶ²æ·Ö²śĪļĪ“±ź³ö)
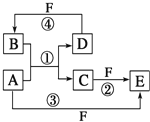
£Ø1£©ČōAĪŖ¶ĢÖÜĘŚ½šŹōµ„ÖŹ£¬DĪŖ¶ĢÖÜĘŚ·Ē½šŹōµ„ÖŹ£¬ĒŅĖłŗ¬ŌŖĖŲµÄŌ×ÓŠņŹżAŹĒDµÄ2±¶£¬Ėłŗ¬ŌŖĖŲµÄŌ×Ó×īĶā²ćµē×ÓŹżDŹĒAµÄ2±¶£¬FµÄÅØČÜŅŗÓėA”¢D·“Ó¦¶¼ÓŠŗģ×ŲÉ«ĘųĢåÉś³É£¬ŌņĪļÖŹCÖŠĖłŗ¬»Æѧ¼üĄąŠĶĪŖĪŖ____________£¬·“Ó¦¢ÜµÄ»Æѧ·½³ĢŹ½ĪŖ____________________________£»
£Ø2£©ČōAŹĒ³£¼ūµÄ½šŹōµ„ÖŹ£¬D”¢FŹĒĘųĢ¬µ„ÖŹ£¬ĒŅ·“Ó¦¢ŁŌŚĖ®ČÜŅŗÖŠ½ųŠŠ£®·“Ó¦¢ŚŅ²ŌŚĖ®ČÜŅŗÖŠ½ųŠŠ£¬ĘäĄė×Ó·½³ĢŹ½ŹĒ_____________________£»¼ģŃéEĪļÖŹÖŠŃōĄė×ӵIJŁ×÷ŗĶĻÖĻó___________£¬Aµ„ÖŹÓė1mol/LĻ”ĻõĖį160mLĒ”ŗĆ·“Ó¦£¬×ī¶ąĻūŗÄAµ„ÖŹ______________g£»
£Ø3£©ČōA”¢D”¢F¶¼ŹĒ¶ĢÖÜĘŚ·Ē½šŹōŌŖĖŲµ„ÖŹ£¬ĒŅA”¢DĖłŗ¬ŌŖĖŲĶ¬Ö÷×壬A”¢FĖłŗ¬ŌŖĖŲĶ¬ÖÜĘŚ£¬Ōņ·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ___________________________________________£»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦:NO2(g) + SO2(g)![]() SO3(g) + NO(g) £¬ĘšŹ¼Ź±ĻņijĆܱÕČŻĘ÷ÖŠĶØČė1 mol NO2 ”¢ 2 mol S18O2£¬.·“Ó¦“ļµ½Ę½ŗāŗó£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ:
SO3(g) + NO(g) £¬ĘšŹ¼Ź±ĻņijĆܱÕČŻĘ÷ÖŠĶØČė1 mol NO2 ”¢ 2 mol S18O2£¬.·“Ó¦“ļµ½Ę½ŗāŗó£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ:
A.NO2ÖŠ²»æÉÄÜŗ¬18OB.ÓŠ1 mol N18OÉś³É
C.S18O2µÄĪļÖŹµÄĮæ²»æÉÄÜĪŖ0. 8 molD.SO2”¢SO3”¢NO”¢NO2¾łŗ¬18OŹ±£¬ĖµĆ÷øĆ·“Ó¦“ļµ½Ę½ŗā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ¢ŁNa2O2¢ŚO2¢ŪHClO¢ÜH2O2¢ŻCl2¢ŽNaClO¢ßO3ĘßÖÖĪļÖŹ¶¼¾ßÓŠĒæŃõ»ÆŠŌ”£Ēė»Ų“šĻĀĮŠĪŹĢā:
£Ø1£©ÉĻŹöĪļÖŹÖŠ»„ĪŖĶ¬ĖŲŅģŠĪĢåµÄŹĒ_____(ĢīŠņŗÅ,ĻĀĶ¬)”£
£Ø2£©ŗ¬·Ē¼«ŠŌ¼üµÄ¹²¼Ū»ÆŗĻĪļŹĒ_____”£
£Ø3£©ŹōÓŚĄė×Ó»ÆŗĻĪļµÄÓŠ_____ÖÖ”£
£Ø4£©Na2O2”¢HCIO”¢H2O2¾łÄÜÓĆÓŚÖʱøO2”£
¢ŁHClOŌŚ¹āÕÕĢõ¼žĻĀ·Ö½āÉś³ÉO2ŗĶHCl,ÓƵē×ÓŹ½±ķŹ¾HClµÄŠĪ³É¹ż³Ģ_____”£
¢ŚŠ“³öNa2O2ÓėH2O·“Ó¦µÄ·½³ĢŹ½²¢±ź³öµē×Ó×ŖŅĘ·½ĻņŗĶŹżÄæ_____”£
¢ŪH2O2ŌŚ¶žŃõ»ÆĆĢ“ß»Æ×÷ÓĆĻĀæÉŅŌÖʱøO2”£Čō6.8gH2O2²Ī¼Ó·“Ó¦,Ōņ×ŖŅʵē×ÓŹżÄæĪŖ_____£¬Éś³É±ź×¼×“æöĻĀO2Ģå»żĪŖ_____L”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æC60”¢½šøÕŹÆ”¢ŹÆÄ«”¢¶žŃõ»ÆĢ¼ŗĶĀČ»Æļ¤µÄ½į¹¹Ä£ŠĶČēĶ¼ĖłŹ¾£ØŹÆÄ«½ö±ķŹ¾³öĘäÖŠµÄŅ»²ć½į¹¹£©£ŗ
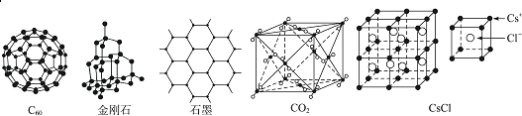
£Ø1£©C60”¢½šøÕŹÆŗĶŹÆÄ«ČżÕߵĹŲĻµŹĒ»„ĪŖ_____”£
A£®Ķ¬·ÖŅģ¹¹Ģå B£®Ķ¬ĖŲŅģŠĪĢå C£®Ķ¬ĻµĪļ D£®Ķ¬Ī»ĖŲ
£Ø2£©¹ĢĢ¬Ź±£¬C60ŹōÓŚ_____£ØĢī”°Ō×Ó”±»ņ”°·Ö×Ó”±£©¾§Ģ唣
£Ø3£©¾§Ģå¹čµÄ½į¹¹øś½šøÕŹÆĻąĖĘ£¬1mol¾§Ģå¹čÖŠŗ¬ÓŠ¹č©¹čµ„¼üµÄŹżÄæŌ¼ŹĒ_____NA”£
£Ø4£©ŹÆÄ«²ćד½į¹¹ÖŠ£¬Ę½¾łĆæøöÕżĮł±ßŠĪÕ¼ÓŠµÄĢ¼Ō×ÓŹżŹĒ_____”£
£Ø5£©¹Ū²ģCO2·Ö×Ó¾§Ģå½į¹¹µÄŅ»²æ·Ö£¬ŹŌĖµĆ÷ĆæøöCO2·Ö×ÓÖÜĪ§ÓŠ_____øöÓėÖ®½ōĮŚĒŅµČ¾ąµÄCO2·Ö×Ó£»øĆ½į¹¹µ„ŌŖĘ½¾łÕ¼ÓŠ_____øöCO2·Ö×Ó”£
£Ø6£©¹Ū²ģĶ¼ŠĪĶĘ²ā£¬CsCl¾§ĢåÖŠĮ½¾ąĄė×ī½üµÄCs+¼ä¾ąĄėĪŖa£¬ŌņĆæøöCs+ÖÜĪ§ÓėĘä¾ąĄėĪŖaµÄCs+ŹżÄæĪŖ_____£¬ĆæøöCs+ÅäĪ»ŹżĪŖ_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķŹĒŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö£¬±ķÖŠĖłĮŠµÄ×ÖÄø·Ö±š“ś±ķijŅ»»ÆѧŌŖĖŲ”£
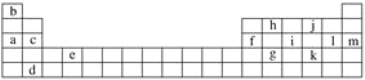
±ķÖŠĖłĮŠŌŖĖŲÖŠ£ŗ
ŹōÓŚ¶ĢÖÜĘŚŌŖĖŲµÄÓŠ_____________________________________£ØĢī×ÖÄø£¬ĻĀĶ¬£©£»ŹōÓŚÖ÷×åŌŖĖŲµÄÓŠ__________________________________________£»eŌŖĖŲŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒµŚ__________ÖÜĘŚµŚ__________×唣
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹Ų»Æѧ·ūŗűķÕ÷ÕżČ·µÄŹĒ
A. µē½ā·Ø¾«Į¶Ķ£¬Ņõ¼«µē¼«·“Ó¦£ŗCu2++2e£== Cu
B. H2SŌŚĖ®ČÜŅŗÖŠµÄµēĄė£ŗH2S![]() 2H++ S2£
2H++ S2£
C. ¼×ĶéµÄČ¼ÉÕČČĪŖ890.3 kJ”¤mol£1£¬Ōņ¼×ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖ£ŗCH4 (g)£«2O2 (g) ==CO2 (g)£«2H2O (g) ¦¤H£½£890.3 kJ”¤mol£1
D. Ģ¼ĖįÄĘĖ®½āµÄĄė×Ó·½³ĢŹ½£ŗCO32£+2H2O![]() 2OH£+H2CO3
2OH£+H2CO3
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com