
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
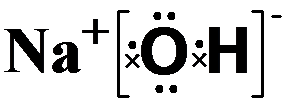 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).分析 ①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为Cl;⑧只有最高价+3,处于ⅢA族,原子半径小于P,故⑧为B,以此来解答.
解答 解:①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为Cl;⑧只有最高价+3,处于ⅢA族,原子半径小于P,故⑧为B,
(1)由上述分析可知,③的元素符号是Li,⑧的元素名称是硼,故答案为:Li;硼;
(2)在最高价氧化物的水化物中,酸性最强的化合物的名称是高氯酸,碱性最强的化合物NaOH的电子式为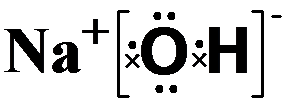
故答案为:高氯酸;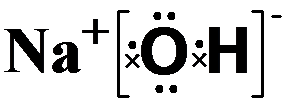
(3)④为P、⑦为N,二者同主族,电子层越多非金属性越弱,故非金属性N>P,则氢化物稳定性NH3>PH3,故答案为:NH3>PH3;
(4)⑦的最高价氧化物对应水化物为硝酸,它的氢化物为氨气,二者反应的化学方程式为:NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3;
(5)②最高价氧化物对应水化物为Mg(OH)2,⑤的氢化物水溶液为盐酸,二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子结构推断元素等为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2 SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,K+、OH-、S2-、NO3-能大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,离子方程式为:2Fe2++ClO-+2H+→Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
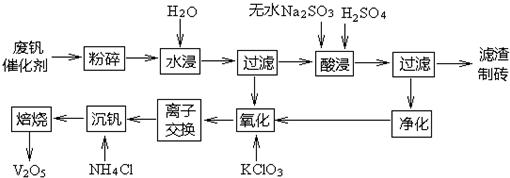
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 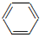 +HO-Na2$→_{60℃}^{浓硫酸}$ +HO-Na2$→_{60℃}^{浓硫酸}$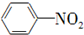 +H2O +H2O | |
| C. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | |
| D. | CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com