

| A.图甲表示向乙酸溶液中通入氨气,此过程中溶液导电性的变化 |
| B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 |
| C.图丙表示25℃时,用0.1 mol/L盐酸滴定20mL 0.1 mol/L氨水,溶液的pH随加入盐酸体积的变化 |
| D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化 |
科目:高中化学 来源:不详 题型:问答题
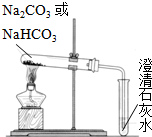
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
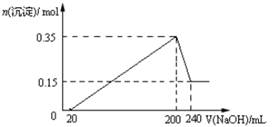
| A.镁和铝的总质量为9 g |
| B.最初20 mLNaOH溶液用于中和过量的硫酸 |
| C.硫酸的物质的量浓度为2.5 mol·L-1 |
| D.生成的氢气在标准状况下的体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是| A.在焙烧明矾的反应中,还原剂与氧化剂的物质的量之比是3:4 |
| B.最后得到的K2SO4溶液呈中性,所以c(K+)=c(SO42-) |
| C.焙烧产生的SO2可用于制硫酸,焙烧948 t明矾(M=" 474" g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸432 t |
D.工业上冶炼Al2O3制得Al,以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH  NaAlO2+3Ni(OH)2 NaAlO2+3Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
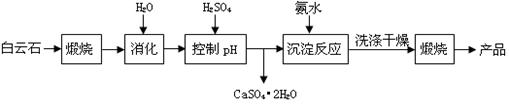
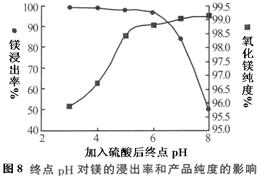
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
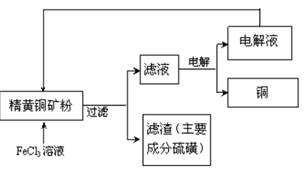
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
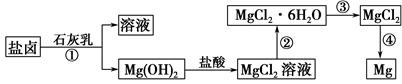
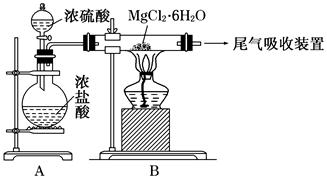
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.Ca(ClO)2(aq) HClO(aq) HClO(aq) HCl(aq) HCl(aq) |
B.H2SiO3 SiO2 SiO2 SiCl4 SiCl4 |
C.Al2O3 NaAlO2(aq) NaAlO2(aq)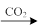 Al(OH)3 Al(OH)3 |
D.Fe2O3 Fe2(SO4)3(aq) Fe2(SO4)3(aq) 无水Fe2(SO4)3 无水Fe2(SO4)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com