
| A. | 向0.10 mol•L-1 NH4HCO3溶液中通CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10 mol•L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10 mol•L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10 mol•L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
分析 室温下,向下列溶液中通入相应的气体至溶液pH=7,反应后溶液呈中性,则c(H+)=c(OH-),
A.反应后溶液为c(H+)=c(OH-),结合电荷守恒判断;
B.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立判断;
C.未反应前结合物料守恒可知c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],向0.10mol•L-1Na2SO3溶液通入SO2,至溶液pH=7,反应后溶液中溶质为NaHSO3、Na2SO3;
D.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,反应后溶液中溶质为NaCl、醋酸和醋酸钠.
解答 解:室温下,向下列溶液中通入相应的气体至溶液pH=7,反应后溶液呈中性,则c(H+)=c(OH-),
A.向0.10 mol•L-1 NH4HCO3溶液中通CO2,溶液为中性:c(H+)=c(OH-),根据核电荷数可知:c(NH4+)=c(HCO3-)+2c(CO32-),故A错误;
B.溶液中钠离子与S原子物质的量之比为1:1,而铵根离子与部分亚硫酸根结合,故c(Na+)>c(NH4+),由物料守恒可知,c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),溶液呈中性,由电荷守恒可得:c(Na+)+c(NH4+)=2c(SO32-)+c(HSO3-),联立可得:c(NH4+)+c(H2SO3)=c(SO32-),则c(SO32-)>c(NH4+),故B错误;
C.向0.10mol•L-1Na2SO3溶液通入SO2,发生Na2SO3+SO2+H2O=2NaHSO3,至溶液pH=7,反应后溶液中溶质为的NaHSO3、Na2SO3,则c(Na+)<2[c(SO32-)+c(HSO3-)+c(H2SO3)],故C错误;
D.向0.10mol•L-1CH3COONa溶液中通入HCl,至溶液pH=7,c(H+)=c(OH-),HCl不足,反应后溶液中溶质为NaCl、醋酸和醋酸钠,由电荷守恒可知,c(Na+)=c(CH3COO-)+c(Cl-),由物料守恒可知,c(Na+)=c(CH3COOH)+c(CH3COO-),则c(Na+)>c(CH3COOH)=c(Cl-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,题目难度中等,明确盐类水解、弱电解质的电离及物质之间发生的反应是解本题关键,注意题给信息的灵活运用,会正确运用守恒解答问题,试题有利于提高学生的分析能力及灵活应用能力.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 | |
| B. | 盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气 | |
| C. | SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 | |
| D. | 常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2O2中加入足量水:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| B. | 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2++2H+=Ag++2NH4+ | |
| C. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.10 mol | D. | 0.20 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
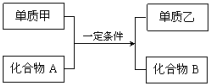 置换反应的通式可表示为:
置换反应的通式可表示为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向Na2SiO3溶液中滴加几滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| B | 取久置的Na2O2粉末,向其中滴加过量的盐酸后产生气体 | Na2O2没有变质 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀 | 溴乙烷没有水解 |
| D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com