
| 物质 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.6 | 7.3 | 7.0 | 9.6 |
| 完全沉淀 | 3.8 | 4.7 | 9.3 | 9.0 | 12.0 |
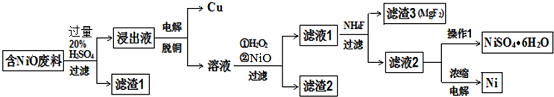
分析 某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,加入稀硫酸溶解后过滤得到滤渣1为SiO2,滤液为NiSO4、FeSO4、CuSO4、Al2(SO4)3,、MgSO4,浸出液通过电解铜离子得到电子析出铜,溶液中脱铜后的溶液中加入过氧化氢氧化亚铁离子,再加入氧化镍调节溶液PH,使铁离子,铝离子全部沉淀,过滤得到滤渣2为氢氧化铁和氢氧化铝沉淀,滤液1中加入NH4F沉淀Mg2+,生成沉淀滤渣3为MgF2,过滤得到的滤液2,滤液2中获得NiSO4.6H2O晶体的方法是通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到晶体,电解浓缩后的滤液2可获得金属镍,据此答题.
解答 解:废料提取NiSO4和Ni的流程为:某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,加入稀硫酸溶解后过滤得到滤渣1为SiO2,滤液为NiSO4、FeSO4、CuSO4、Al2(SO4)3,、MgSO4,浸出液通过电解铜离子得到电子析出铜,溶液中脱铜后的溶液中加入过氧化氢氧化亚铁离子,再加入氧化镍调节溶液PH,使铁离子,铝离子全部沉淀,过滤得到滤渣2为氢氧化铁和氢氧化铝沉淀,滤液1中加入NH4F沉淀Mg2+,生成沉淀滤渣3为MgF2,过滤得到的滤液2,滤液2中获得NiSO4.6H2O晶体的方法是通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到晶体,电解浓缩后的滤液2可获得金属镍;
(1)上述分析可知,滤渣1主要成分为SiO2,
故答案为:SiO2;
(2)溶液中得到溶质晶体的方法是依据溶质溶解度随温度变化,通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到结晶水合物,从滤液2中获得NiSO4.6H2O的实验操作是加热浓缩、冷却结晶,过滤、洗涤、干燥,
故答案为:加热浓缩、冷却结晶;
(3)加入H2O2的作用是在酸性溶液中氧化亚铁离子为铁离子,调节溶液PH易于沉淀,过氧化氢发生反应的离子方程式为:2H++H2O2+2Fe2+═2Fe3++2H2O;
故答案为:2H++H2O2+2Fe2+═2Fe3++2H2O;
(4)加入氧化镍调节溶液PH,使铁离子,铝离子全部沉淀,反应的离子方程式有 2Fe3++3NiO+3H2O=2Fe(OH)3+3Ni2+、2Al3++3NiO+3H2O=2Al(OH)3+3Ni2+,
故答案为:2Fe3++3NiO+3H2O=2Fe(OH)3+3Ni2+、2Al3++3NiO+3H2O=2Al(OH)3+3Ni2+;
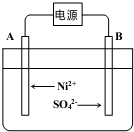
(5)滤液2为NiSO4溶液,电解NiSO4溶液,
①根据图示可知,A电极反应式为 Ni2++2e-=Ni 和2H++2e-═H2↑,
故答案为:Ni2++2e-=Ni;
②一段时间后在A、B两极均收集到11.2L气体(标准状况下),气体物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,
阳极电极反应:Ni2++2e-═Ni
1mol 0.5mol
2H++2e-=H2↑;
1mol 0.5mol
阴极电极反应为4OH--4e-=2H2O+O2↑
2mol 0.5mol
生成Ni物质的量为0.5mol,质量为0.5mol×59/mol=29.5g,
故答案为:29.5.
点评 本题考查了物质分离和制备流程的分析判断,主要是实验基本操作和电解池原理的分析应用,物质性质和电极反应书写、电子守恒的计算应用是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝投入NaOH溶液中:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| B. | 石英与烧碱反应:SiO2+2OH-═SiO32-+H2O | |
| C. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向小苏打溶液中加入过量Ba(OH)2:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维是信息社会必不可少的有机合成材料 | |
| B. | 食盐加碘实质是在食盐中加入KIO3 | |
| C. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 | |
| D. | 焚烧垃圾会产生大量污染空气的物质,故不宜采用此法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、OH-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷 | B. | 2-甲基-5-乙基-1-己烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 3,3-二甲基-2-戊烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com