
| A. | 1.0 mol•L-1CH3COONa溶液中含有CH3COO-的个数为NA | |
| B. | 1.0 L 1.0 mol•L-1NaAlO2溶液中含有的铝原子数为NA | |
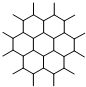
| C. | 如图是石墨晶体结构的俯视图,含1 mol C的石墨中六元环个数为$\frac{{N}_{A}}{2}$ | |
| D. | 22.4 L N2中所含的σ键数目为NA |
分析 A.溶液体积未知;
B.依据n=CV结合1mol偏铝酸钠含有1mol铝原子解答;
C.每个碳原子被3个六元环公用,根据均摊法,一个六元环中含有的C原子数目为:1×$\frac{1}{3}$×6=2,12g石墨烯中含有1mol碳原子,能够形成0.5mol六元环;
D.气体状况未知.
解答 解:A.溶液体积未知,无法计算醋酸根离子个数,故A错误;
B.1.0 L 1.0 mol•L-1NaAlO2溶液中含有偏铝酸钠共1.0L×1.0mol/L=1.0mol,共含有铝原子数为NA,故B正确;
C.12g石墨烯中含有12gC,含有1molC,每个六元环中含有2g碳原子,所以1molC原子可以形成0.5mol六元环,含六元环的个数为0.5NA,故C正确;
D.气体状况未知,无法确定氮气的物质的量,无法计算氮气所含的σ键数目,故D错误;
故选:BC.
点评 本题考查了阿伏伽德罗常数的判断与计算,题目难度中等,熟悉以物质的量为核心的计算公式,明确石墨的结构、气体摩尔体积使用条件是解题关键.


科目:高中化学 来源: 题型:实验题
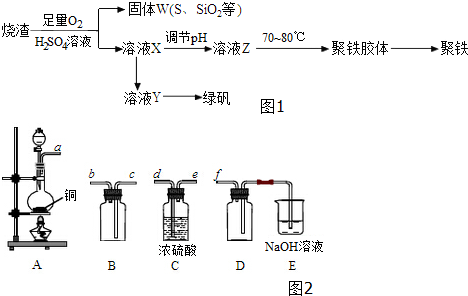
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
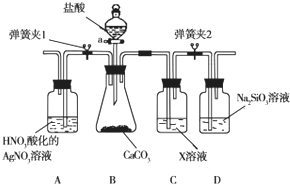 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
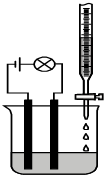 某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:
某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:| Ba(OH)2(ml) | 溶液中的总离子浓度(mol/L) |
| 0.0 | 0.30 |
| 5.0 | 0.10 |
| 10.0 | ≈0.00 |
| 15.0 | 0.06 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上将NH3与CO2在高温高压下制成[CO(NH2)2] | |
| B. | 空气中的O2和N2在闪电时化合成NO | |
| C. | 豆科植物的根瘤菌把氮气变为NH3 | |
| D. | 工业上用N2和H2来合成NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用双缩脲试剂可区分蛋白质溶液和淀粉溶液 | |
| B. | 用水可区分苯,甲苯和溴苯 | |
| C. | 用高锰酸钾酸性溶液可区分乙烷和乙烯 | |
| D. | 用溴水可鉴别苯酚溶液,2-己烯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com