
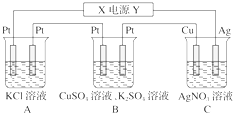
 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g.试回答下列问题.分析 (1)由铜电极的质量增加,则Cu电极为阴极,可知X为电源的负极;
(2)A为电解氯化钾溶液,生成氯气、氢气和氢氧化钾;
(3)B中电解硫酸铜溶液生成硫酸,pH减小;本着“出来什么,加入什么物质的组合”的原理来分析加入的物质;
(4)①C中的Ag电极为阳极,银本身放电;
②B中的阳极上OH-放电;
(5)根据电极反应及电子守恒来计算;
(6)在碱性甲烷燃料电池中,负极上是甲烷放电生成CO32-,结合碱性环境来分析电极方程式的书写.
解答 解:(1)由铜电极的质量增加,发生Ag++e-═Ag,则Cu电极为阴极,Ag为阳极,Y为正极,可知X为电源的负极,故答案为:负;
(2)A为电解氯化钾溶液,生成氯气、氢气和氢氧化钾,方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;
(3)B中电解硫酸铜溶液生成硫酸,溶液中氢离子浓度增大,pH减小;B池中阴极的电极反应为:Cu2++2e-=Cu,阳极电极反应为:4OH--4e-═2H2O+O2↑,故从B池中出来的物质由铜和氧气,故要使电解液复原,应加入CuO或CuCO3,故答案为:变小,CuO或CuCO3;
(4)①C中的Ag电极为阳极,银本身放电,故电极反应为:Ag-e-═Ag+,故答案为:Ag-e-═Ag+;
②B中的阳极上OH-放电,电极反应为:4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
(5)C中阴极反应为Ag++e-═Ag,n(Ag)=$\frac{2.16g}{108g/mol}$=0.02mol,则转移的电子为0.02mol,B中阳极反应为4OH--4e-═2H2O+O2↑,则转移0.02mol电子生成氧气为0.005mol,其体积为0.005mol×22.4L/mol=0.112L=112mL,
则在阴极也生成112mL气体,由2H++2e-═H2↑,则氢气的物质的量为0.005mol,该反应转移的电子为0.01mol,
则Cu2++2e-═Cu中转移0.01mol电子,所以Cu2+的物质的量为0.005mol,通电前c(CuSO4)=$\frac{0.005mol}{0.2L}$=0.025 mol•L-1;
故答案为:0.025mol/L;
(6)在碱性甲烷燃料电池中,负极上是甲烷放电生成CO32-,结合碱性环境可知电极方程式为:CH4-8e-+10OH-=CO32-+7H2O.故答案为:CH4-8e-+10OH-=CO32-+7H2O.
点评 本题考查电解原理,明确Cu电极的质量增加是解答本题的突破口,并明确发生的电极反应及电子守恒即可解答,注意计算时电子守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Mg17Al12是离子化合物 | |
| B. | 为防止金属氧化,熔炼制备Mg17Al12时通氮气做保护气 | |
| C. | 732 g的合金能吸收380.8 L氢气 | |
| D. | 该合金的熔点比镁和铝的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L 0.5mol/LNa2S溶液中含有的S2-个数为NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ba2+、NO3-、CO32- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | Na+、K+、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的N2和CO所含分子数均为NA | |
| B. | 一定温度下,1 L 1 mol•L-1的CH3COONa溶液含NA个CH3COO- | |
| C. | 1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含的电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的分子个数比为3:1:2 | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | 混合气体的密度不再改变 | |
| D. | 单位时间内生成3n mol X,同时消耗n mol Y |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 充电时储氢合金作阳极 | |
| B. | 充电时阳极周围pH增大 | |
| C. | 放电时负极反应:LaNi5H6+6OH--6e-═LaNi5+6H2O | |
| D. | 放电时每转移6mol电子,有6moLNiO(OH)被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com