
| A. | 溶解度 | B. | 溶质的质量分数 | C. | 溶剂的质量 | D. | 溶液的质量 |
分析 氯化钾的溶解度随着温度的升高而增大,随着温度的降低而减小,50℃的某氯化钾饱和溶液冷却至10℃时,温度降低,氯化钾的溶解度减小,有氯化钾晶体析出,据此进行分析判断.
解答 解:A.溶解度与温度有关,温度改变,溶解度改变,故A不选;
B.氯化钾的溶解度随着温度的升高而增大,随着温度的降低而减小,溶液质量分数:$\frac{S}{S+100}$×100%,溶解度改变所以溶液质量分数改变,故B不选;
C.50℃时的KCl饱和溶液,降低10℃,氯化钾溶解度减小,溶质质量减小,溶剂质量不变,故C选;
D.50℃时的KCl饱和溶液,降低10℃,氯化钾溶解度减小,溶质的质量减小,溶剂质量不变,溶液质量减小,故D不选;
故选C.
点评 本题考查了物质的溶解度和饱和溶液的特征,掌握氯化钾的溶解度受温度影响的变化趋势、饱和溶液结晶析出后溶液组成的变化是正确解答本题的关键.


科目:高中化学 来源: 题型:解答题
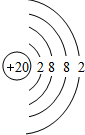 .
.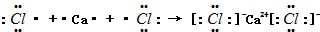 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
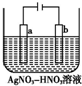 燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.
燃料电池是将乙醇通入负极,O2通入正极而发生电池反应的,其能量转换率高.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClCH2CH2Cl+2CH3NH2→CH3NHCH2CH2NHCH3+2HCl 取代反应 | |
| B. |  +CH${\;}_{{\;}_{3}}$CH2OH→ +CH${\;}_{{\;}_{3}}$CH2OH→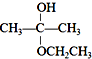 加成反应 加成反应 | |
| C. | HOCH2CH2CH2OH$\stackrel{浓硫酸}{→}$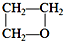 +H2O消去反应 +H2O消去反应 | |
| D. | nCH2=O$\stackrel{一定条件}{→}$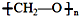 加聚反应 加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加了酚酞的溶液变红色 | B. | 产生气体推动Na游动 | ||
| C. | Na沉在水下 | D. | Na熔成光亮小球 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 方法 | |
| A | 乙烷 | 乙烯 | 一定条件下与H2反应使乙烯转化为乙烷 |
| B | 乙炔 | H2S | 通入CuSO4溶液的洗气瓶洗气 |
| C | 溴苯 | Br2 | 加NaOH溶液后分液 |
| D | 工业酒精 | H2O(转为无水酒精) | 加入生石灰,蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
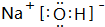 .
.| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH═Na2SO3+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com