

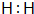 .
.分析 金属A能与既能与盐酸反应生成气体C,又能与NaOH反应生成气体C,则A为Al,C为H2,B为AlCl3,D为NaAl2,E为Al(OH)3,据此解答.
解答 解:金属A能与既能与盐酸反应生成气体C,又能与NaOH反应生成气体C,则A为Al,C为H2,B为AlCl3,D为NaAl2,E为Al(OH)3.
(1)由上述分析可知,金属A为Al,故答案为:Al;
(2)C为H2,电子式为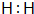 ,故答案为:
,故答案为: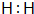 ;
;
(3)反应③是氯化铝与氨水反应生成氢氧化铝沉淀与氯化铵,化学方程式为:AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl,
故答案为:AlCl3+3NH3•H2O═Al(OH)3↓+3NH4Cl;
(4)反应④是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查无机物推断,涉及Al元素单质化合物的性质与转化,“金属A能与盐酸、氢氧化钠反应生成气体”是推断突破口,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
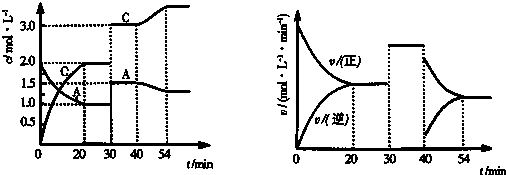
 ;Z的氢化物结构式为
;Z的氢化物结构式为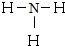 ;写出U元素在周期表中的位置第三周期第VIA族.
;写出U元素在周期表中的位置第三周期第VIA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液与稀盐酸混合 | B. | 硫酸钠溶液与氯化钾溶液混合 | ||
| C. | 稀硫酸与氢氧化钠溶液混合 | D. | 氢氧化钠溶液与硫酸铜溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可用如图所示装置进行多个实验探究,请回答下列问题.
实验室可用如图所示装置进行多个实验探究,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属单质 | B. | 非金属单质 | C. | 可溶性碱 | D. | 可溶性盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH20中含NA个质子 | |
| B. | 1L 1mol•L一1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24L Cl2中含0.2NA个氯原子 | |
| D. | 0.5mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
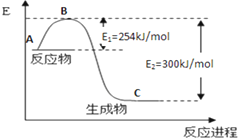 氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用,
氮是地球上含量丰富的一种元素,氮及其化合物在工 农业生产、生活中有着重要作用,| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-1-丁醇 | B. | 2,2-二甲基-1-丁醇 | ||
| C. | 2-甲基-2-丁醇 | D. | 2,3-二甲基-2-丁醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com