
【题目】标准状况下,现有![]() ;
;![]() 个HCl分子;
个HCl分子;![]() ;
;![]()
![]() ,对这四种气体的关系有以下四种表述:其中正确的是 ______ .
,对这四种气体的关系有以下四种表述:其中正确的是 ______ .
a.体积:![]()
b.物质的量:![]()
c.质量:![]()
d.氢原子个数:![]()
【答案】a、c、d
【解析】
a.![]() 个HCl分子的物质的量为0.5mol,标准状况下的体积为11.2L,13.6gH2S的物质的量为0.4mol,标准状况下的体积为8.96L,0.2molNH3的体积为4,48L,体积②>③>①>④,故a项正确;b.甲烷的物质的量为6.67L/22.4L.mol-1=0.3mol;
个HCl分子的物质的量为0.5mol,标准状况下的体积为11.2L,13.6gH2S的物质的量为0.4mol,标准状况下的体积为8.96L,0.2molNH3的体积为4,48L,体积②>③>①>④,故a项正确;b.甲烷的物质的量为6.67L/22.4L.mol-1=0.3mol; ![]() 个HCl分子的物质的量为0.5mol ,13.6gH2S的物质的量为0.4mol;
个HCl分子的物质的量为0.5mol ,13.6gH2S的物质的量为0.4mol;![]()
![]() ;所以物质的量:
;所以物质的量:![]() ,故b不正确;c.甲烷的质量为0.4
,故b不正确;c.甲烷的质量为0.4![]() 16=6.4g氯化氢的质量为18.25g,硫化氢的质量为13.6g,氨气的质量为3.4g,质量②>③>①>④,故c项正确;d.甲烷中氢原子个数为1.2mol,氯化氢中氢原子个数为0.5mol,H2S中氢原子个数为0.8mol,氨气中氢原子个数为0.6mol,氢原子个数①>③>④>②,故d项正确。答案:a、c、d。
16=6.4g氯化氢的质量为18.25g,硫化氢的质量为13.6g,氨气的质量为3.4g,质量②>③>①>④,故c项正确;d.甲烷中氢原子个数为1.2mol,氯化氢中氢原子个数为0.5mol,H2S中氢原子个数为0.8mol,氨气中氢原子个数为0.6mol,氢原子个数①>③>④>②,故d项正确。答案:a、c、d。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
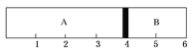
(1)A室混合气体所含分子总数为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氢气密度的________倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH。回答下列问题:
(1)CH3SH(甲硫醇)的电子式为________。
(2)一种脱硫工艺为:真空K2CO3—克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为lgK=_____(已知:H2CO3 lgK1=-6.4,lgK2=-10.3;H2SlgK1=-7,lgK2=-19)。
②已知下列热化学方程式:
a.2H2S(g)+3O2(g)=2SO2(g)+ 2H2O(l) △H1=-1172kJ/mol
b.2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2=-632kJ/mol
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为__________。
(3)Dalleska等人研究发现在强酸溶液中可用H2O2氧化COS。该脱除反应的化学方程式为______________。
(4)COS水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H=-35.5kJ/mol。
CO2(g)+H2S(g) △H=-35.5kJ/mol。
用活性α-Al2O3催化,在其它条件相同时,改变反应温度,测得COS水解转化率如图1所示;某温度时,在恒容密闭容器中投入0.3molH2O(g)和0.1molCOS,COS的平衡转化率如图2所示。
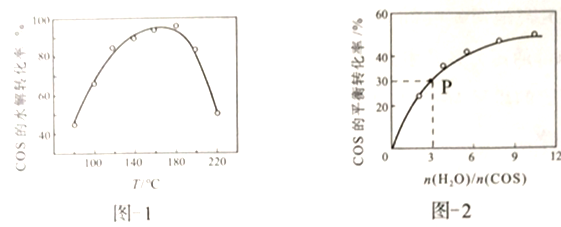
①图1活性α-Al2O3催化水解,随温度升高转化率先增大后又减小的可能原因是________。
②由图2可知,P点时平衡常数为K=______(填数字)。
③活性α-Al2O3催化水解,为提高COS的转化率可采取的措施是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。 据此下列说法错误的是
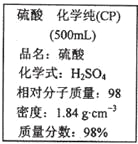
A. 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管
B. 取10 mL该硫酸于烧杯中,再加等体积的水,可配得49%的硫酸
C. 配制200mL4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某些地区曾发生用石蜡油等工业用油加工大米的“毒米事件”,威胁人民健康。食用油和石蜡油虽然都称作“油”,但从化学组成和分子结构看,它们是完全不同的。下列说法正确的是( )
A.食用油属于纯净物,石蜡油属于混合物
B.食用油属于酯类,石蜡油属于烃类
C.食用油属于有机物,石蜡油属于无机物
D.食用油属于高分子化合物,石蜡油属于小分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.汽车尾气排放的NOX和CO污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOX和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g), △H=-566.0kJ·mol-1
2CO2(g), △H=-566.0kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g)△H=+180.5 kJ·mol-1
2NO(g)△H=+180.5 kJ·mol-1
回答下列问题:
(1)CO的燃烧热为___________,若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___________kJ。
(2)为了模拟反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4 kJ·mol-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3kJ·mol-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)___________。
②能说明上述反应达到平衡状态的是___________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
(3)在某恒容容器中发生下列反应:2NO2(g)![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。

该反应为___________反应(填“吸热”或“放热”),已知图中a点对应温度下,NO2的起始压强P0为120kPa,计算该温度下反应的平衡常数Kp的值为___________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅱ.N2H4-O2燃料电池是一种高效低污染的新型电池,其装置如图所示:
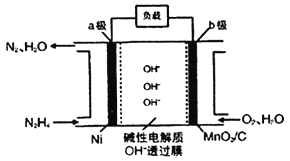
N2H4的电子式为___________;a极的电极反应方程式为___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代在西汉《淮南子·万毕术》一书中有湿法炼铜的文字记载:“曾青得铁则化铜”铜金属被广泛地应用于电力、电子、交通、轻工、新兴产业等领域。
回答下列问题:
(1)铁原子的外围电子排布图为___________。
(2)向FeCl3溶液加入KSCN溶液形成K3[Fe(SCN)6]血红色溶液。
①写出与SCN-离子互为等电子体的合理分子或离子:_____________。(两个)
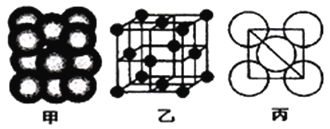
②铁原子的堆积方式如右图(甲)所示,其晶胞特征如右图(乙)所示,原子之间相互位置关系的平面图如右图(丙)所示;已知铁原子半径rpm,铁晶胞空间利用率为:____________。(用字母π表示)
(3)含有Fe2+的水溶液可以用K3[Fe(CN)6]于实验室的定性检验,检验Fe2+离子的离子方程式为:___________。
(4)一水合硫酸四氨合铜[Cu(NH3)4]SO4·H2O为蓝色正交晶体,常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。
①[Cu(NH3)4]SO4·H2O中非金属元素H、N、O的电负性由大到小的顺序为:___________。(用元素符号作答)
②[Cu(NH3)4]SO4·H2O晶体中存在的化学键有___________ (填编号)
a金属键 b离子键 c氢键 d配位键 e极性键 f非极性键
③NH3分子的VSEPR模型为:___________;SO42-中S为___________杂化。
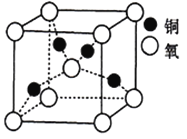
(5)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为acm,则该氧化物的密度为______g/cm3(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某同学对有关物质进行的分类:

(1)每组分类均有错误,其错误的物质分别是__________、__________、____________(填化学式)。
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是__________________(填化学式);
②“三酸”与“两碱”之间均可反应,请用化学方程式表示硫酸与烧碱和纯碱的反应:______________________________、__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com