
| A. | 上述弱酸溶液的pH=4 | |
| B. | 加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大 | |
| C. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH=7 | |
| D. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH<7 |
分析 A.根据电离平衡常数计算氢离子浓度;
B.电离平衡常数只与温度有关,与溶液的酸碱性无关;
C.等体积等浓度的一元酸碱混合,根据盐的类型判断溶液的酸碱性;
D.等体积等浓度的一元酸碱混合,根据盐的类型判断溶液的酸碱性.
解答 解:A.c(H+)=$\sqrt{{K}_{a}•c}$=$\sqrt{0.01×1{0}^{-6}}$=10-4 mol/L,所以溶液的pH=4,故A正确;
B.酸的电离平衡常数只与温度有关,与溶液的酸碱性无关,所以向酸中加入氢氧化钠溶液虽然促进弱酸电离,但电离平衡常数不变,故B错误;
C.等体积等浓度的该酸和氢氧化钠恰好反应生成强碱弱酸盐,溶液呈碱性,溶液的pH>7,故C错误;
D.等体积等浓度的该酸和氢氧化钠恰好反应生成强碱弱酸盐,溶液呈碱性,溶液的pH>7,故D错误;
故选A.
点评 本题考查溶液pH的计算、弱电解质的电离,题目难度中等,根据盐的类型、氢离子浓度来分析解答即可,注意电离平衡常数只与温度有关,为易错点,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K+、C6H5OH、Br-、NO3- | |
| B. | 在氨水溶液中 Al3+、NO3-、Cl-、Ag+ | |
| C. | 某透明澄清的溶液中:NH4+、Fe3+、NO3-、Cl- | |
| D. | 能使甲基橙显红色的溶液:K+、Cr2O72-、CH3CH2OH、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn 2++Cu | |
| B. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| C. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 和化学式中M分别代表阳离子,图中
和化学式中M分别代表阳离子,图中 和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )
和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )| A. | 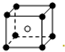 | B. | 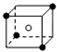 | C. | 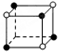 | D. | 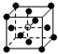 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
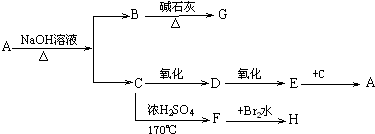
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Br | B. | CH3CH2CH2CH2Br | C. | CH2BrCH2Br | D. | CH3CHBrCH2CH2Br |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com