
分析 已知气体B可使湿润红色石蕊试液变蓝,B是氨气,2.40gNaH的物质的量为0.1mol和氨气B反应生成3.90g化合物A和0.1molH2,根据质量守恒,参与反应的氨气的物质的量为0.1mol,根据质量守恒则A化学式为NaNH2,由此分析解答.
解答 解:已知气体B可使湿润红色石蕊试液变蓝,B是氨气,2.40gNaH的物质的量为0.1mol和氨气B反应生成3.90g化合物A和0.1molH2,根据质量守恒,参与反应的氨气的物质的量为0.1mol,根据质量守恒则A化学式为NaNH2,
(1)A的化学式是NaNH2,故答案为:NaNH2;
(2)NaH与气体B反应生成化合物A的化学方程式:NaH+NH3=NaNH2+H2,故答案为:NaH+NH3=NaNH2+H2;
(3)A是足量盐酸发生非氧化还原反应的化学方程式NaNH2+2HCl=NaCl+NH4Cl,故答案为:NaNH2+2HCl=NaCl+NH4Cl;
(4)在高温下(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为2NaH+TiCl4=Ti+2NaCl+2HCl,故答案为:2NaH+TiCl4=Ti+2NaCl+2HCl;
(5)因为亚硫酸盐具有极强的还原性,吸收液”通过蒸发结晶制得的固体可能是亚硫酸盐和硫酸盐的混合物,故答案为:不合理;通过蒸发结晶制得的固体可能是亚硫酸盐和硫酸盐的混合物,所以得到的固体不一定是纯净物,可能是亚硫酸钡和硫酸钡的混合物.
点评 本题考查知识点较多,化学方程的书写,质量守恒定律的应用、氧化还原反应方程式的配平、元素化合物的性质等,属于拼合型题目,需要学生具备扎实的基础,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸 | B. | 氨水 | C. | AgNO3 溶液 | D. | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
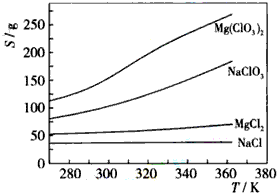 (1)下列有关硅单质及其化合物的说法正确的是B.
(1)下列有关硅单质及其化合物的说法正确的是B.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
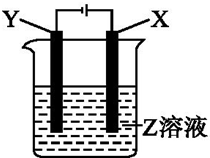 根据如图所示装置回答:
根据如图所示装置回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
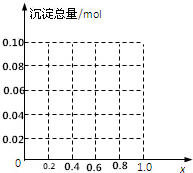 现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.
现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1mol,在此溶液中加入90mL浓度为4mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | ②多 | C. | ①多 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氨水与稀盐酸反应:H++OH-═H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 金属钠着火时使用泡沫灭火器灭火 | |
| C. | 验证氯气能否与水反应的实验时,用氢氧化钠溶液处理尾气 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com