
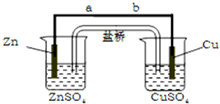
分析 该装置为原电池,Zn为负极,Cu为正极,电子由负极流向正极,溶液中阴离子向负极移动;根据电极方程式中Cu与电子的关系计算.
解答 解:(1)该装置为原电池,Zn为负极,Cu为正极,电子由负极流向正极,则电子流向为由a到b(或a→b),
故答案为:由a到b(或a→b);
(2)电池工作时,溶液中阴离子向负极移动,则盐桥中向ZnSO4溶液中迁移的离子是SO42-;
故答案为:D;
(3)铜电极发生Cu2++2e-=Cu,增加0.64g,n(Cu)=$\frac{0.64g}{64g/mol}$=0.01mol,转移0.02mol电子,转移电子数目为0.02molNA,故答案为:0.02molNA.
点评 本题考查原电池原理,侧重电子流向、离子移动方向、转移电子数的计算等知识的考查,注重学生基础知识和基本能力的考查,明确计算中的电子守恒及电极反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极为锌 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 | |
| D. | 电池正极反应式为:2MnO2+2e一+2H2O═2MnO (OH)+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
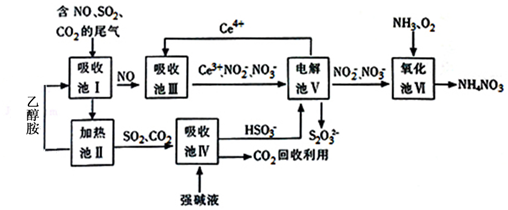
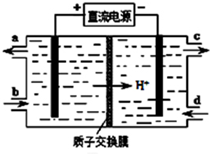
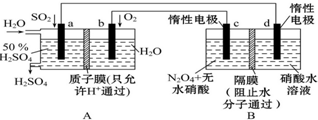 膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图:
膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
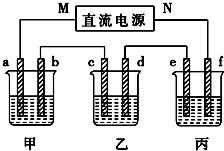 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 | |
| B. | 氧化剂在反应中失去电子,还原剂在反应中得到电子 | |
| C. | 金属离子在反应中可能被氧化、也可能被还原 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com