
【题目】铁及其化合物在有机化学中应用广泛,例如有机合成中,常用铁和盐酸将硝基(﹣NO2)还原为氨基(﹣NH2);在苯的溴代反应中用溴化铁作催化剂。
(1)N的原子结构示意图为_______,Fe基态原子核外电子排布式为_______。
(2)H、N、O 的电负性从小到大的顺序是_______。
(3)与NO2+互为等电子体的一种分子为_____(填化学式),氨基(﹣NH2)中氮原子的杂化类型为_____。
(4)1mol苯分子中含有σ键的物质的量为______。
(5)Fe 与 N 形成的某化合物晶胞如图所示,则该晶体的化学式为_______。

【答案】 ![]() 1s22s22p63s23p63d64s2或[Ar]3d64s2 H<N<O N2O(或CO2、CS2等) sp3杂化 12mol(或12×6.02×1023) Fe4N
1s22s22p63s23p63d64s2或[Ar]3d64s2 H<N<O N2O(或CO2、CS2等) sp3杂化 12mol(或12×6.02×1023) Fe4N
【解析】
试题(1)铁的原子序数为26,根据能量最低原理,其基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;
(2)在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,可知电负性强弱顺序为H<N<O;
(3)NO2+的电子数为22,其等电子体为N2O(或CO2、CS2等);氨基(-NH2)中氮原子形成3个δ键,一个孤对电子,价层电子对数为4,氮原子为sp3杂化;
(4)苯分子中碳碳之间含有一个σ键,共6个;碳氢之间含有一个σ键,共6个;所以1mol苯分子中含有σ键的数目为12×6.02×1023;
(5)在该晶胞中,含有Fe:8×1/8+6×1/2=4,N为2个,则该晶体的化学式为Fe4N。


科目:高中化学 来源: 题型:
【题目】某学习小组的同学按下列实验流程制备Na2CO3,设计的部分装置如图所示。
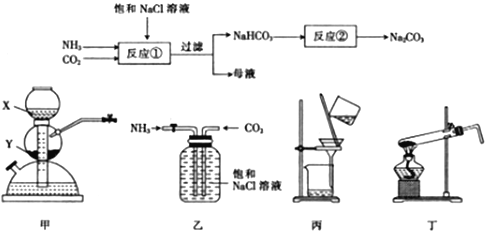
下列叙述正确的是
A. 若X为浓氨水,Y为生石灰,则可用装置甲制取NH3
B. 反应①可在装置乙中发生,反应②可在装置丁中发生
C. 可用装置丙进行过滤操作
D. 将母液蒸干灼烧后可得到NH4Cl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )

①X、Y的最高价氧化物的水化物酸性为Y<X;②Y、Z的气态氢化物的稳定性Y<Z;③W的单质常温下呈液态,一定条件下可与铁粉反应;④W的原子序数比Z大9。
A. 只有③ B. ①② C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①甲醛(HCHO)与葡萄糖化学性质相似,都具有还原性。②甲醛易挥发,甲酸钙易溶于水。为探究过量的甲醛和新制Cu(OH)2反应的产物,进行如下实验:
(1)在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5mol·L-1NaOH 溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热20分钟后冷却至室温。

仪器a、b的名称分别是________________、_______________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A 和如下图所示装置连接后进行实验。

依次连接的合理顺序为A→____→____→____→____→____→G。副产物中如果有CO,实验现象是:_____________________________________。
(3)已知HCHO 最终被氧化为CO32-,请写出a容器中发生的反应化学方程式:_________________________________________。
(4)反应后a中有红色固体产生,为探究其组成,提出如下假设:
假设一:只有Cu2O 假设二:只有Cu
假设三:CuO和Cu 假设四:_______________;
其中假设三明显不成立,理由是___________________________________。
(5)为了对(4)的猜想进行验证,进行如下实验(以下任步均充分反应):
已知:已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+ (蓝色)
[Cu(NH3)4]2+ (蓝色)
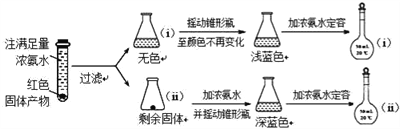
①锥形瓶ii中固体加入浓氨水后,完全溶解得到深蓝色溶液,该过程所发生的离子方程式为 __________________________________________;
②将容量瓶ii中的溶液稀释20倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】益康唑是一种抗真菌药物,可通过以下方法合成:
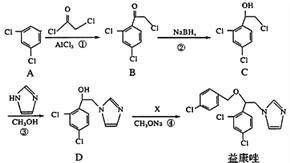
(1)化合物B中含有的官能团名称为________、________;反应②的类型是______反应
(2)反应④中加入的试剂X分子式为C7H6Cl2,则X的结构简式为____________
(3)同时满足下列条件的C的同分异构体一共有_______种;请写出其中任意一种的的结构简式:______________________。
I.能与FeCl3溶液发生显色反应;II.分子中只有2种不同化学环境的氢。
(4)在一定条件下,化合物C与足量氢氧化钠溶液反应的化学方程式为:__________________。
(5)根据本题的相关信并结合已有知识,写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图(乙醇和无机试剂任用)________。合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(乙醇和无机试剂任用)________。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3-、MnO4-B.Mg2+、Na+、Cl-、SO42-
C.K+、Na+、Cu2+、Cl-D.Ba2+、Na+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在元素周期表中的位置,反映了元素的原子结构和元素的性质,右图所示是元素周期表的一部分:

(1)元素N在元素周期表中的位置为第______周期________族。根据元素周期律,请预测H3AsO4、H3PO4的酸性强弱:H3AsO4_________ H3PO4 (填“>”“<”或“=”)。
(2)根据NaH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正化合价与最低负化合价的绝对值相等,又可把氢元素放在元素周期表中的________族。
(3)元素甲是第3周期金属元素中原子半径最小的元素,该元素的离子与过量的氨水反应的离子方程式为_________________________。
(4)元素周期表中有10多种人体所需的微量元素,其中有一种被誉为“生命元素”的主族元素R,对延长人类寿命起着重要作用。已知R的原子有4个电子层,其最高价氧化物的分子式为RO3,则R的名称为______(填序号)。
A.硫 B.砷 C.硒 D.硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
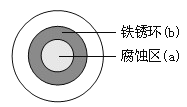
A. 液滴中的Cl―由a区向b区迁移
B. 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C. 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D. 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前汽车上使用的电瓶大多仍是铅蓄电池,其构造示意图如下。发生反应的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法不正确的是
2PbSO4(s)+2H2O(l),下列说法不正确的是
A. 放电时,电解质溶液的pH值增大
B. 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g
C. 放电时,溶液中H+向PbO2电极移动
D. 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-=PbSO4(s)+2H2O(l)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com