
 为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:
为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:| 78y |
| 53x+25y |
| 78y |
| 53x+25y |
| y×10 -3 |
| 22.4 |
| y×10 -3 |
| 22.4 |
| (x-y)×10 -3 |
| 22.4 |
| (x-y)×10 -3 |
| 22.4 |
| y×10 -3 |
| 22.4 |
| (x-y)×10 -3 |
| 22.4 |
| m(过氧化钠) |
| m(过氧化钠)+m(碳酸钠) |
| 78y |
| 53x+25y |
| 78y |
| 53x+25y |


科目:高中化学 来源: 题型:解答题
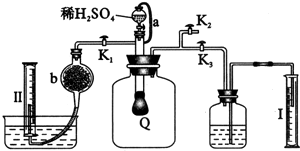 为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:
为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
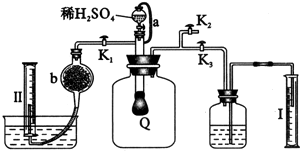
查看答案和解析>>
科目:高中化学 来源:0103 期末题 题型:实验题

查看答案和解析>>
科目:高中化学 来源:2011年河北省衡水市故城县郑口中学高考化学模拟试卷(解析版) 题型:解答题
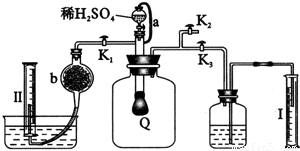
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com