
| 1000ρw |
| M |
| 1000×1.2×25% |
| 75 |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:

| A、W的原子序数可能是Y的原子序数的2倍 |
| B、X可能为氢元素 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、X、Y、Z、W四种元素的最外层电子数之和可能为25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3 |
| B、Mg |
| C、NaHCO3 |
| D、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
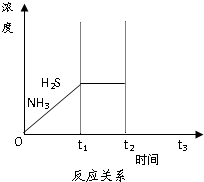 脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.
脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示的是向某NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸产生CO2的过程.请回答下列问题:
如图表示的是向某NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸产生CO2的过程.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com