
(15分)烧碱(NaOH)和纯碱(Na2CO3)与硫酸、盐酸和硝酸并称为工业上的“三酸两碱”。按要求回答下列问题:
(1)完成下列有关NaOH溶液参加反应的离子方程式
①向NaOH溶液中加入铝片:_______________________;
②向NaOH溶液中滴加少量氯化铝溶液___________________;
③二氧化氮与NaOH溶液发生氧化还原反应:___________________;
④用热的NaOH溶液洗涤沾有硫单质的试管:___________________;
(2)下列是碳酸钠和碳酸氢钠的性质比较,用“>”“<”“=”填空:
①热稳定性:Na2CO3_______NaHCO3;
②与稀盐酸反应快慢:Na2CO3_______NaHCO3;
③物质的量相同时,消耗盐酸的物质的量:Na2CO3_______NaHCO3。
(3)在10 mL 1 mol/L的纯碱溶液中,不断搅拌并逐滴加入10 mL 1.5 mol/L盐酸,完全反应后,在标准状况下生成二氧化碳的体积为____________L。
(4)碳酸钠在工业上具有广泛的作用,碳酸钠可以用作下列工业生产主要原料的是_____(填编号)
a.玻璃 b.水泥 c.造纸 d.海水提取镁
(1)2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
Al3++4OH-=Al(OH)4]- 2NO2+2OH-=NO3-+NO2-+H2O
3S+6OH- 2S2-+SO32-+3H2O(不写条件扣1分)
2S2-+SO32-+3H2O(不写条件扣1分)
(2) ①>;②<;③>(每空均为1分) (3)0.112 (4)a、c(每个1分,错一个倒扣1分)
解析试题分析:(1)①铝能和强碱氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。
②由于氢氧化铝是两性氢氧化物,能溶解在强碱中,因此向NaOH溶液中滴加少量氯化铝溶液生成偏铝酸钠、氯化钠,反应的离子方程式为Al3++4OH-=Al(OH)4]- 。
③二氧化氮与NaOH溶液发生氧化还原反应生成硝酸钠、亚硝酸钠和水,反应的离子方程式为2NO2+2OH-=NO3-+NO2-+H2O。
④在加热的条件下氢氧化钠溶液能溶解单质硫生成亚硫酸钠、硫化钠和水,因此用热的NaOH溶液洗涤沾有硫单质的试管发生反应的离子方程式为3S+6OH- 2S2-+SO32-+3H2O。
2S2-+SO32-+3H2O。
(2)①碳酸氢纳加热易分解生成碳酸钠、水和CO2,所以热稳定性:Na2CO3>NaHCO3;
②碳酸钠与盐酸反应分步进行,即Na2CO3+HCl=NaCl+NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑,因此与稀盐酸反应快慢:Na2CO3<NaHCO3;
③根据反应式Na2CO3+2HCl=2NaCl+H2O+CO2↑、NaHCO3+HCl=NaCl+H2O+CO2↑可知,物质的量相同时,消耗盐酸的物质的量:Na2CO3>NaHCO3。
(3)碳酸钠的物质的量=0.01L×1mol/L=0.01mol,盐酸的物质的量=0.01L×1.5mol/L=0.015mol。碳酸钠与盐酸反应分步进行,则
Na2CO3+HCl=NaCl+NaHCO3
0.01mol 0.01mol 0.01mol
此时还剩余盐酸的物质的量是0.005mol,则
NaHCO3 +HCl=NaCl+H2O+CO2↑
0.005mol 0.005mol 0.005mol
剩余实际生成的CO2是0.005mol
标准状况下的体积=0.005mol×22.4L/mol=0.112L
(4)工业生产玻璃的主要原料是纯碱、石灰石和石英;生产水泥的主要原料是黏土和石灰石;造纸主要原料是植物纤维,但需要用碳酸钠溶解纤维;海水中提取镁主要是一石灰石和盐酸为主要原料,因此答案选ac。
考点:考查氢氧化钠、碳酸钠的性质、用途以及有关方程式书写和计算等


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
工业生产纯碱的工艺流程示意图如下: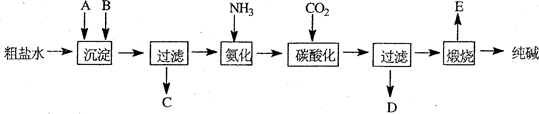
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A 、B 。
(2)碳酸化后发生反应的化学方程式是 。
(3)向母液 (选填图中字母)中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(4)不用其它试剂,检查副产品NH4Cl是否纯净的方法及操作是 .
(5)Xg纯碱产品(含有碳酸氢钠)充分加热分解后,质量减少了Yg,则纯碱样品中碳酸氢钠的质量分数可表示为 。
(6)有人以硫酸钠和焦炭、石灰石在高温下进行煅烧,再浸取,结晶而制得纯碱。反应的化学方程式为_________ __ (已知产物之一为CaS);
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| ①将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
| ②反应结束后分离出溶液备用。 | |
| ③红色固体用蒸馏水洗涤后,置于潮湿空气中。 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3]。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下: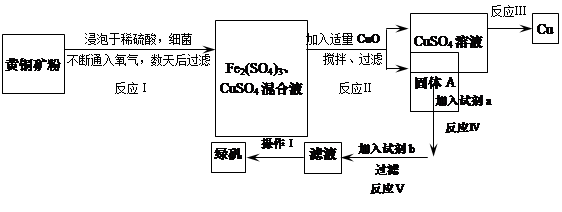
回答下列问题:
(1)已知:
| | Fe2+ | Cu2+ | Fe3+ |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。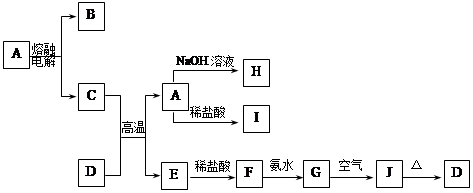
请回答下列问题:
(1)A的化学式为 ,在水中的溶解性 (选填“易溶”、“可溶”、“难溶”)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
反应的现象是 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上,将黄铜矿(CuFeS2)通过8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
8Cu+4FeO+2Fe2O3+16SO2反应制取铜及其硫和铁的化合物。
(1)上述反应中,还原剂为 。
(2)黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.通过上述②,炉渣中的Al2O3变成了 (写离子)。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
(3)对上述炉渣中进行含铁量的测定步骤如下: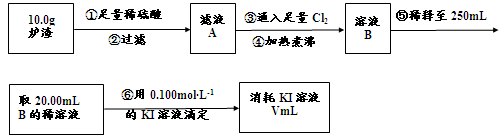
I.步骤③发生反应的离子方程式为 。
II.步骤④中煮沸的作用是 。
III.步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
IV.若滴定过程中消耗0.100mol·L?1KI溶液20.00mL,则炉渣中铁的百分含量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝土矿(主要成分为Al2O3,还有少量杂质)是提取氧化铝的原料。提取氧化铝的工艺流程如下: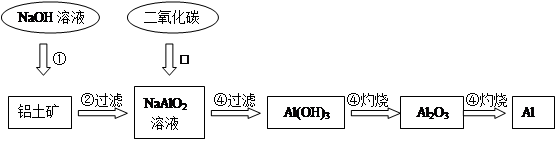
(1)请用离子方程式表示以上工艺流程中第①步反应:_______ _______。
(2)写出以上工艺流程中第③步反应的化学方程式:______ ___________。
(3)金属铝与氧化铁混合在高温下,会发生剧烈的反应。该反应的化学方程式_____________。请举一例该反应的用途________________。
(4)电解熔融氧化铝制取金属铝,若有0.9mol电子发生转移.理论上能得到金属铝的质量是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
(1)上述五中物质中沸点最低物质的结构式为______________,由上述物质中的两种元素按原子个数比1:1形成的离子化合物的电子式为__________________(写一例)
(2)Al元素的单质有许多不同于其他金属的特性,请列举2例(也可以用化学方程式表示)
______________________、__________________________________.
(3)氢有3种稳定同位素,H氕、 D氘、 T氚,分别为丰度a、b、c,则计算氢元素的近似相对原子质量的表达式为______________________________________________.
甲认为H可以排在周期表ⅠA族,也可以排在ⅦA族;而乙同学认为H也可以与碳一样,排在ⅣA族,乙同学的理由是__________________________________________________。
(4)己知通入二氧化碳336 L(标准状况下),理论上生成Al(OH)3 ________________mol,
实际上生成24 mol Al(OH)3和15 mol Na2CO3,Al(OH)3比理论上要少的原因是:________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是
(填字母)。
| A.硬度比钢小,熔点比钢高 | B.不能与盐酸反应 |
| C.与不锈钢成分相同 | D.在冷的浓硫酸中钝化 |
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com