
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为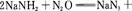
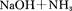
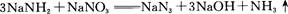 回答下列问题:
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是 ,第一电离能最小的元素是 。
(2)基态氮原子的L层电子排布图为 。
(3)与N3-互为等电子体的分子为 (写出一种)。依据价层电子对互斥理论,NO3-的空间构型为 。
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为 。叠氮化钠的水溶液呈碱性,用离子方程式表示其原因: 。
(5)N20沸点(一88.49℃比NH3沸点(一33.34℃)低,其主要原因是
(6)安全气囊的设计原理为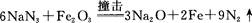
①氮分子中δ键和π键数目之比为 。
②铁晶体中存在的化学键类型为 。
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为
(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。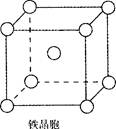
22. (1)氟(或F) 锂(或Li)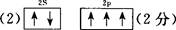
(3)CO2或N2O 平面三角形
(4)离子晶体(1分)
(5)氨分子间存在氢键 (6)1:2 金属键 
解析试题分析:(1)氮元素在第二周期,同周期,从左向右电负性依次增大(稀有气体除外),故为氟;第一电离能逐渐增大,故最小的为锂;(2)氮原子L层上有5个电子,先排s上的2个电子,再排p上的三个电子;(3)N3-价电子总数为16,等电子体的为价电子总数相等的CO2或N2O;先算出孤电子对数为(5+1-2×3)/2=0,成键电子对为3,故为sp2杂化,故为平面三角形;(4)两者均含有钠离子和阴离子,故为离子晶体,盐溶液显碱性为阴离子水解,故为N3-结合水电离出的氢离子生成氨气和氢氧根离子;(5)氨气分子能形成分子间氢键,沸点升高;(6)①氮气中形成氮氮三键,有一条δ键和2条π键,故为1:2;②铁为金属晶体,存在金属键;③晶胞的体积为a3,有8个铁原子位于顶点,一个位于中心,故晶胞完全占有的铁原子数目为2个,质量为 ×2g,质量除以体积得密度。
×2g,质量除以体积得密度。
考点:电负性和第一电离能的递变规律、晶体类型的判断、氢键对性质的影响、杂化类型的判断、晶胞的计算等知识。


科目:高中化学 来源: 题型:填空题
(10分)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是 ,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是 ,最高价氧化物水化物显两性的氢氧化物的化学式是 。
(2)③与④的气态氢化物的稳定性由大到小的顺序是 。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)下表是元素周期表的一部分,请回答有关问题: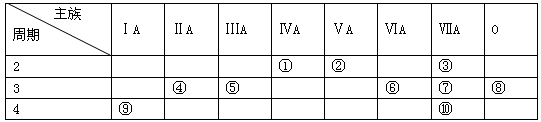
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 。
(3)①、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(4)③元素与⑩元素两者核电荷数之差是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
⑴判断离子AB2-离子的空间构型为 。
⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。
⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。
⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。
该化合物的化学式为 。
⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 。
②1 mol该配合物中含配位键的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______,Na在氧气中完全燃烧所得产物的电子式为_______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BeO的熔点________(填“高”或“低”)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为______;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为______(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg3He同时可得6000kgH2和700kgN2,若以所得H2和N2为原料经一系列反应最多可制得碳酸氢铵___kg。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)4种相邻的主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
| | | m | n |
| x | y | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学—--选修3:物质结构与性质】(15分)
金属铜与金属锰及其化合物在工业上有着广泛的应用:
(1)Cu2+的外围电子排布图可表示为 ;
(2)Mn基态原子核外处在能量最高的能级上的电子共有 种不同的运动状态;
(3)在铜锰氧化物的催化下,空气中CO被氧化成CO2,HCHO被氧化成CO2和H2O
① N3-和CO2是等电子体,则N3-的结构式为 ;
② HCHO分子中C原子轨道的杂化类型为 ;
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(5) 用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm(提示:3.613=47.05),又知铜的密度为9.00g·cm-3,则铜晶胞的质量是
g(保留两位小数);阿伏加德罗常数为 (列式计算,保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下: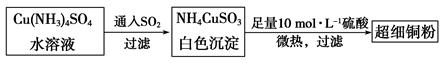
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②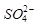 的空间构型为_____________,
的空间构型为_____________,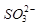 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 ( 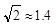 ,列式并计算结果)。
,列式并计算结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com