
| A. | N2的电子式: | |
| B. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | S2-的结构示意图: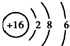 | |
| D. | O原子的基态电子排布式为:1s22s22p${\;}_{x}^{2}$p${\;}_{y}^{2}$p${\;}_{z}^{0}$. |
分析 A.氮气分子中含有氮氮三键,N原子最外层达到8电子稳定结构,该电子式中漏掉了N原子的1对孤电子对;
B.质量数=质子数+中子数,元素符号左上角为质量数、左下角为质子数;
C.硫离子的核外电子总数为18,最外层达到8电子稳定结构;
D.2p轨道的4个电子的分步为2p$\stackrel{2}{x}$p$\stackrel{1}{y}$p$\stackrel{1}{z}$p.
解答 解:A.氮气中氮原子之间通过三键均达到了8电子稳定结构,氮气正确的电子式为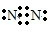 ,故A错误;
,故A错误;
B.质子数为53、中子数为78的碘原子的质量数为131,该原子可以表示为:${\;}_{53}^{131}$I,故B正确;
C.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,故C错误;
,故C错误;
D.O元素为8号元素,原子核外有8个电子,其核外电子正确的排布式为1s22s22 p$\stackrel{2}{x}$p$\stackrel{1}{y}$p$\stackrel{1}{z}$p,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、元素符号、核外电子排布式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
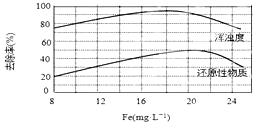
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
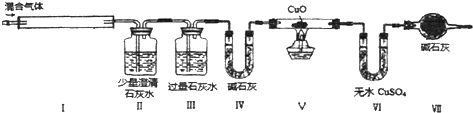
| A. | 混合气体中一定有NO2和CO | |
| B. | 混合气体中一定没有H2和NH3 | |
| C. | 混合气体中一定含有H2、NO、CO2、HCl四种气体 | |
| D. | 不能确定混合气体中是否有NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
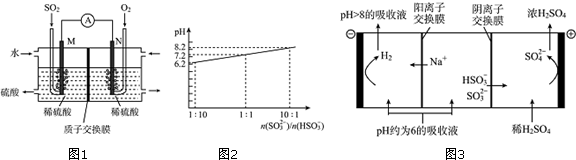
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶. | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知度的盐酸时,选用酚酞作指示剂,实验时不小心多加了几滴 | |
| D. | 用标准盐酸测定未知浓度NaOH结束实验,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com