
铁及其化合物在国民经济的发展中起着重要作用。
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
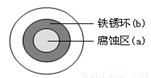
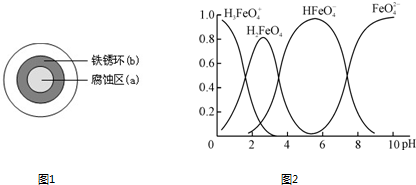
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是 区(填“正极”或“负极”),其电极反应式为 。
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O= TiO2+(无色)+Fe2++2H+
③ 。
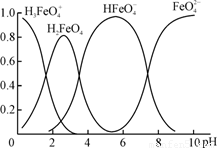
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是 。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁 g。
(1)+489.0
(2)正极 O2+2H2O+4e-=4OH-
(3)2Fe3++Fe=3 Fe2+
(4)①AB ②4FeO+10H2O=4Fe(OH)3+8OH-+3O2↑
(5)2.8 g
【解析】
试题分析: (1)由盖斯定律得,△H=-110.5 kJ·mol-1×3-[(-1642 kJ·mol-1)÷2]= +489.0kJ·mol-1。(2)铁发生吸氧腐蚀,液滴边缘电极反应式为O2+2H2O+4e-=4OH-,液滴边缘为正极区。(3)加入的Fe与Fe3+生成Fe2+。(4)pH为2时,铁元素有三种存在形态,pH为4、6、8时,铁元素有两种存在形态,A错误;向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数先增大后减小,B错误;pH=6的这种溶液中加KOH溶液,FeO分布分数增大,HFeO分布分数减小,离子方程式为HFeO+OH-=FeO+H2O,C正确。(5)混合物中加盐酸后,再加KSCN溶液不显红色说明溶液中溶质为FeCl2,Fe与Cl物质的量比为1:2,Cl来自盐酸,物质的量为0.1mol,所以Fe元素物质的量为0.05mol,用CO还原同质量的混合物得到铁物质的量亦为0.05mol,质量为2.8g。
考点: 盖斯定律 原电池 离子方程式 图像的分析 化学计算


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:阅读理解
| FeO | 2- 4 |
| O | - 4 |
| O | - 4 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)铁及其化合物在国民经济、日常生活中占有非常重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
(1)铁在自然界中以 态存在,其氧化物呈黑色的是 ,呈红褐色的是 (填写化学式)。
(2)铁在纯氧气中燃烧的化学方程式为 。
铁在氯气中反应的产物是 。
(3)要验证一种溶液中是否含有Fe3+、Fe2+,正确的实验方法是 。
A.向甲试管中加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
B.向乙试管中加入试液,滴入氯水,若氯水褪色,证明一定存在Fe2+。
C.向丙试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中一定存在Fe3+
(4)铁合金有下列数据:
| 钢 | |||
| 碳素钢(Fe、C、Mn、Si) | 合金钢 | ||
| 低碳钢 | 中碳钢 | 高碳钢 | 碳素钢+Cr、Mn、W、Ni、Co等 |
| 含碳量<0.3% | 含碳量0.3%--0.6% | 含碳量>0.6% | |
| 韧性好,强度低 | 韧性好、强度好 | 硬而脆 | 具有特殊性能 |
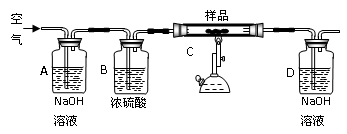
取15g某碳素钢样品,按下列实验流程进行操作:
①A、B的作用是 ,
②充分加热完全反应后,D装置质量增加0.022g,该样品属于 钢。
③没有A、B装置,实验结果 (填“偏高”“偏低”“不影响”)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年陕西省陕师大附中高一上学期期末试题化学(理)试卷 题型:填空题
(15分)铁及其化合物在国民经济、日常生活中占有非常 重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
(1)铁在自然界中以 态存在,其氧化物呈黑色的是 ,呈红褐色的是 (填写化学式)。
(2)铁在纯氧气中燃烧的化学方程式为 。
铁在氯气中反应的产物是 。
(3)要验证一种溶液中是否含有Fe3+、Fe2+,正确的实验方法是 。
A.向甲试管中 加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
B.向乙试管中加入试液,滴入氯水,若氯水褪色,证明一定存在Fe2+。
C.向丙试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中一定存在Fe3+
(4)铁合金有下列数据:
| 钢 | |||
| 碳素钢(Fe、C、Mn、Si) | 合金钢 | ||
| 低碳钢 | 中碳钢 | 高碳钢 | 碳素钢+Cr、Mn、W、Ni、Co等 |
| 含碳量<0.3% | 含碳量0.3%--0.6% | 含碳量>0.6% | |
| 韧性好,强度低 | 韧性好、强度好 | 硬而脆 | 具有特殊性能 |
查看答案和解析>>
科目:高中化学 来源:2014届陕西省高一上学期期末试题化学(理)试卷 题型:填空题
(15分)铁及其化合物在国民经济、日常生活中占有非常重要的地位,了解铁及其化合物的性质和用途非常重要。请回答下列问题:
(1)铁在自然界中以 态存在,其氧化物呈黑色的是 ,呈红褐色的是 (填写化学式)。
(2)铁在纯氧气中燃烧的化学方程式为 。
铁在氯气中反应的产物是 。
(3)要验证一种溶液中是否含有Fe3+、Fe2+,正确的实验方法是 。
A.向甲试管中加入试液,滴入KSCN溶液,若显血红色,证明一定存在Fe3+。
B.向乙试管中加入试液,滴入氯水,若氯水褪色,证明一定存在Fe2+。
C.向丙试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中一定存在Fe3+
(4)铁合金有下列数据:
|
钢 |
|||
|
碳素钢(Fe、C、Mn、Si) |
合金钢 |
||
|
低碳钢 |
中碳钢 |
高碳钢 |
碳素钢+Cr、Mn、W、Ni、Co等 |
|
含碳量<0.3% |
含碳量0.3%--0.6% |
含碳量>0.6% |
|
|
韧性好,强度低 |
韧性好、强度好 |
硬而脆 |
具有特殊性能 |
取15g某碳素钢样品,按下列实验流程进行操作:

①A、B的作用是 ,
②充分加热完全反应后,D装置质量增加0.022g,该样品属于 钢。
③没有A、B装置,实验结果 (填“偏高”“偏低”“不影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com