
| A. | 在晶体硅中,Si原子与Si-Si键数目比为1:2 | |
| B. | 分子晶体中都存在范德华力,分子内都存在共价键 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
分析 A.在硅晶体中,每个硅原子形成2个Si-Si键;
B.稀有气体为单原子分子不含化学键;
C.HF中存在氢键,氢键的存在能使物质的沸点显著提高;
D.干冰属于分子晶体,氯化铵属于离子晶体
解答 解:A.在硅晶体中,每个硅原子形成2个Si-Si键,所以Si原子与Si-Si键数目比为1:2,故A正确;
B.稀有气体为单原子分子不含化学键,故B错误;
C.HF分子间含有氢键,沸点最高,HCl、HBr、HI,都不含氢键,都为分子晶体,分子间作用力越强,则熔沸点越高,HCl、HBr、HI沸点依次升高,故C错误;
D.干冰属于分子晶体,氯化铵属于离子晶体,受热变为气体所克服的粒子间相互作用分别为分子间作用力和离子键,故D错误,
故选:A.
点评 本题考查了离子晶体、原子晶体、分子晶体的结构和性质,氢键对物质物理性质的影响,题目难度不大,把握形成各种晶体的微粒和相互作用是解题的关键,注意稀有气体属于分子晶体但是不含化学键,氢键属于分子间作用力的一种,对物质的熔沸点、溶解性有显著的影响.


科目:高中化学 来源: 题型:选择题
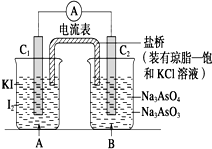 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置| A. | 操作Ⅰ过程中,C1为正极 | |
| B. | 操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 | |
| C. | Ⅰ操作过程中,C2棒上发生的反应为AsO${\;}_{4}^{3-}$+2H++2e-=AsO${\;}_{3}^{3-}$+H2O | |
| D. | Ⅱ操作过程中,C1棒上发生的反应为2I--2e-=I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 裂化汽油 | B. | 直馏汽油 | C. | 甲苯 | D. | 苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1中醋酸电离平衡常数:a点的比b点的小 | |
| B. | 图1中醋酸溶液的pH:a点的比b点的小 | |
| C. | 图2中c点对应的溶液为Fe(OH)3的不饱和溶液 | |
| D. | 由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH约为4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以 CH≡CH 和 HCl 反应制氯乙烯,进而制备聚氯乙烯塑料 | |
| B. | 浓氨水滴入生石灰中,将产生的气体通入 AlCl3溶液,可得到含AlO2-的溶液 | |
| C. | 使用催化剂不能改变工业合成 NH3 的反应限度 | |
| D. | 用浸有 KMnO4溶液的硅土来吸收水果释放的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键 | |
| B. | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 | |
| C. | N2分子中有一个σ键,2个π键 | |
| D. | 在元素周期表中,s区,d区和ds区的元素都是金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度 | B. | 恒容时,再通入2amolC和2amolD | ||
| C. | 恒压时,再通入2amolC和2amolD | D. | 恒容时,再通入amolA和amolB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com