
下列实验能达到实验目的的是
| A.用乙醇萃取碘水中的碘 |
| B.用饱和NaHCO3溶液除去CO2中的HCl |
| C.用Ba(NO3)2溶液鉴别SO32-和SO42- |
| D.用淀粉KI溶液鉴别FeCl3溶液和溴水 |
B
解析试题分析:乙醇与水以任意比例互溶,不能分层,因此不能作碘水的萃取剂,应选择四氯化碳或苯或分馏汽油,故A选项错误;盐酸的酸性比碳酸强,则NaHCO3与HCl容易反应,生成NaCl、H2O和二氧化碳气体,由于二氧化碳气体的溶解度小于NaHCO3和NaCl,所以可用饱和碳酸钠溶液除去二氧化碳中的氯化氢,故B选项正确;钡离子与亚硫酸根离子容易结合生成白色的亚硫酸钡沉淀,钡离子与硫酸根离子容易结合生成白色的硫酸钡沉淀,现象相同,因此只用硝酸钡不能检验亚硫酸根离子和硫酸根离子,故C选项错误;铁离子具有氧化性,能氧化KI,生成单质碘,单质溴也具有氧化性,也能氧化KI,生成单质碘,淀粉遇碘变蓝,则黄色的氯化铁溶液和溴水都能使淀粉KI溶液变蓝,现象相同,因此不能鉴别,故D选项错误。
考点:考查化学实验基本操作及物质的鉴别,涉及乙醇的溶解性、分离碘水中碘的方法、除去二氧化碳中混有的氯化氢、碳酸及盐酸的酸性、二氧化碳的溶解度、亚硫酸根离子和硫酸根离子的检验试剂、氯化铁和溴水的检验试剂等。


科目:高中化学 来源: 题型:单选题
下列实验设计和结论相符的是( )
| A.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液一定有Fe2+ |
| C.向饱和Na2CO3中通入足量CO2,溶液变浑浊,析出了NaHCO3 |
| D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有三组混合物:① 苯和水、② 汽油和柴油、③ 碘和氯化钠溶液,正确的分离方法依次是
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学用下列装置制备并检验Cl2的性质。下列说法正确的是
| A.Ⅰ图中:如果MnO2过量,盐酸可全部被消耗 |
| B.Ⅱ图中:湿润的有色布条褪色,证明Cl2有漂白性 |
| C.Ⅲ图中:生成棕色的固体,证明Cl2有强氧化性 |
| D.Ⅳ图中:光照后量筒中气体体积减小,说明甲烷与Cl2发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
实验室进行NaCl溶液蒸发时,一般有以下操作过程:①固定铁圈位置;②放置酒精灯;③放上蒸发皿;④加热搅拌;⑤停止加热、余热蒸干。其正确操作的顺序是( )
| A.②①③④⑤ | B.①②③④⑤ | C.②③①④⑤ | D.②③①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素。在实验室中,从海藻里提取碘的流程和实验装置如下:
(1)指出上述提取碘的过程中有关实验操作的名称:
步骤③ ,步骤⑤ 。
(2)写出步骤④对应反应的离子方程式: 。
(3)提取碘的过程中,可供选择的有机试剂是 。(填编号)
| A.酒精 | B.醋酸 | C.四氯化碳 | D.苯 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)  2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。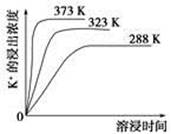
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①________________________________________________________,
②________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ?
? CaCO3(s)+
CaCO3(s)+
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com